Протеинкиназа G (ПК G)
ПК G есть только в легких, мозжечке, гладких мышцах и тромбоцитах, участвует в гуанилатциклазной системе. ПК G содержит 2 субъединицы, стимулируется цГМФ, катализирует реакцию фосфорилирования белков-ферментов.
2)рецепторы, действующие на мембранные ферменты через G-белки и активирующие аденилатциклазную и инозитолтрифосфатную систему. По строению эти рецепторы называют серпантинные. У них выделяют внеклеточный домен, внутриклеточный домен и структуру, многократно пронизывающую мембрану.
G-белки
Универсальные посредники при передаче сигналов от рецепторов к ферментам клеточных мембран, катализирующих образование вторичных посредников гормонального сигнала.
G-белки регулируют активность аденилатциклазы, фосфолипазы С, фосфодиэстеразы, Na+- и K+-каналов. G-белки олигомеры, состоят из 3 субъединиц α, β, γ. Есть активаторные Gs-белки, они активируют мембранные ферменты, есть ингибиторные Gi-белки, они ингибируют мембранные ферменты.
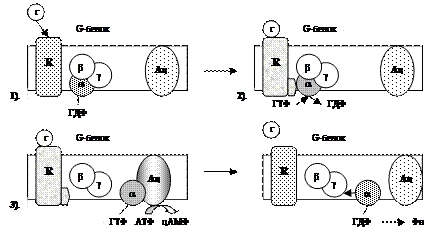
| 1). Гормон (Г), взаимодействуя с рецептором (R), изменяет его конформацию. 2). Рецептор, взаимодействуя с G-белком, уменьшает у α-субъединицы (α) сродство к ГДФ и увеличивает сродство к ГТФ. 3). Присоединение ГТФ к α-субъединице вызывает в G-белке изменение конформации и диссоциацию его на субъединицы: α-субъединицу (α-ГТФ) и димер βγ. α-ГТФ имеет высокое сродство к аденилатциклазе (Ац), его присоединение приводит к активации последней. 4). α-субъединица катализирует распад ГТФ до ГДФ + Фн. α-ГДФ имеет низкое сродство к Ац и высокое к димеру βγ. Отделение α-ГДФ от Ац инактивирует последнюю. |
Аденилатциклаза (АЦ)
Гликопротеин, имеет 8 изоформ, ключевой фермент аденилатциклазной системы, катализирует образование вторичного посредника цАМФ из АТФ. Есть во всех клетках, располагается на внутренней стороне клеточной мембраны. Активность АЦ контролируется: 1) внеклеточными регуляторами - гормонами, эйкозаноидами, биогенными аминами через G-белки; 2) внутриклеточным регулятором Са2+ (4 Са2+-зависимые изоформы АЦ активируются Са2+).
Дата добавления: 2017-05-18; просмотров: 2113;
