Диаграмма состояния. Тройная точка
Если система является однокомпонентной, т. е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния. Согласно § 60, одно и то же вещество в зависимости от соотношения между удвоенной средней энергией, приходящейся на одну степень свободы хаотического (теплового) движения молекул, и наименьшей потенциальной энергией взаимодействия молекул может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Это соотношение, в свою очередь, определяется внешними условиями — температурой и давлением. Следовательно, фазовые превращения также определяются изменениями температуры и давления.
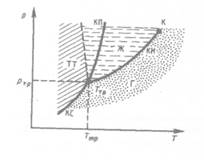
Для наглядного изображения фазовых превращений используется диаграмма состояния (рис. 115),на которой в координатах  задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления
задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления
(КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Кривые на диаграмме называются кривыми фазового равновесия, кажждая точка на них соответствует условиям равновесия двух сосуществующих фаз: КП — твердого тела и жидкости, КИ — жидкости и газа, КС — твердого тела и газа.
Точка, в которой пересекаются эти кривые и которая, следовательно, определяет условия (температуру Ттр и соответствующее ей равновесное давление ртр) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды соответствует температуре 273,16 К (или температуре0,010С по шкале Цельсия) и является основной реперной точкой для построения термодинамической температурной шкалы.
Термодинамика дает метод расчета кривой равновесия двух фаз одного и того же вещества. Согласно ураваешпо Клапейрона — Клаузиуса, производная от равновесного давления по температуре равна
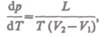 (76.1)
(76.1)
где L — теплота фазового перехода, 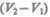 — изменение объема вещества при пере-
— изменение объема вещества при пере-
ходе его из первой фазы во вторую,Т — температура перехода (процесс изотермический).
Уравнение Клапейрона — Клаузиуса позволяет определить наклоны кривых равновесия. Поскольку L и Т положительны, наклон задается знаком 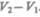 . При испарении
. При испарении
жидкостей и сублимации твердых тел объем вещества всегда возрастает, поэтому, согласно (76.1), 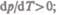 следовательно, в этих процессах повышение температуры
следовательно, в этих процессах повышение температуры
приводит к увеличению давления, и наоборот. При плавлении большинства веществ объем, как правило, возрастает, т. е. 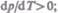 следовательно, увеличение давления
следовательно, увеличение давления
приводит к повышению температуры плавления (сплошная КП на рис. 115). Для некоторых же веществ (Н2О, Ge, чугун и др.) объем жидкой фазы меньше объема
твердой фазы, т. е. 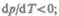 следовательно, увеличение давления сопровождается
следовательно, увеличение давления сопровождается
понижением температуры плавления (штриховая линия на рис. 115).
Диаграмма состояния, строящаяся на основе экспериментальных данных, позволяет судить, в каком состоянии находится данное вещество при определенных р и Т, а также какие фазовые переходы будут происходить при том или ином процессе. Например, при условиях, соответствующих точке l (рис. 116), вещество находится в твердом состоянии, точке 2 — в газообразном, а точке 3 — одновременно в жидком и газообразном состояниях. Допустим, что вещество в твердом состоянии, соответствующем точке 4, подвергается изобарному нагреванию, изображенному на диаграмме состояния горизонтальной штриховой прямой 4—5—6. Из рисунка видно, что при


|
|
температуре, соответствующей точке 5, вещество плавится, при более высокой тем- пературе, соответствующей точке б, — начинает превращаться в газ. Если же вещество находится в твердом состоянии, соответствующем точке 7, то при изобарном нагрева-нии (штриховая прямая 7—8) кристалл превращается в газ минуя жидкую фазу. Если вещество находится в состоянии, соответствующем точке 9, то при изотермическом I сжатии (штриховая прямая 9—10) оно пройдет следующие три состояния: газ — жид- I кость — кристаллическое состояние.
На диаграмме состояний (см. рис. 115 и 116) видно, что кривая испарения закан- I чивается в критической точке К. Поэтому возможен непрерывный переход вещества из I жидкого состояния в газообразное и обратно в обход критической точки, без пересече- I ния кривой испарения (переход 11—12 на рис. 116), т. е. такой переход, который не сопровождается фазовыми превращениями. Это возможно благодаря тому, что раз- личие между газом и жидкостью является чисто количественным (оба эти состояния, например, являются изотропными). Переход же кристаллического состояния (харак- теризуется анизотропией) в жидкое или газообразное может быть только скачкообраз- I ным (в результате фазового перехода), поэтому кривые плавления и сублимации не I могут обрываться, как это имеет место для кривой испарения в критической точке. I Кривая плавления уходит в бесконечность, а кривая сублимации идет в точку, где p=0 и T=0 К.
Дата добавления: 2017-04-20; просмотров: 663;
