Азот и его подгруппа.
Электронная конфигурация ns2np3 и, следовательно, высшая степень окисления равна +5, а низшая степень окисления -3. Устойчивость высшей степени окисления от азота к фосфору увеличивается, а низшей степениокисления уменьшается. Максимальная валентность азота равна IV, а фосфора и остальных элементов V.
N P Sb As Bi
 Увеличение радиусов атомов; уменьшение электроотрицательности и энергии ионизации; увеличение металлических (восстановительных) свойств. Элементы образуют водородные соединения состава RH3; В этих соединениях связи R-H более прочные, чем в соответствующих соединениях VI и VII групп, поэтому водородные соединения элементов V группы в водных растворах не образуют ионов водорода, а проявляют основные свойства:
Увеличение радиусов атомов; уменьшение электроотрицательности и энергии ионизации; увеличение металлических (восстановительных) свойств. Элементы образуют водородные соединения состава RH3; В этих соединениях связи R-H более прочные, чем в соответствующих соединениях VI и VII групп, поэтому водородные соединения элементов V группы в водных растворах не образуют ионов водорода, а проявляют основные свойства:
NH3 + H2O ↔NH4++OH-
Элементы образуют оксиды состава R2O3 R2O5: N2O3 – кислотный; P2O3 – кислотный; Sb2O3 – амфотерный с преобладанием кислотных свойств; As2O3 – амфотерный с преобладанием основных свойств; Bi2O3 – основный оксид. Этим оксидам соответствуют кислоты состава HRO2 и HRO3 (и ортокислоты H3RO4, кроме HNO3).
Азот.
1). Положение в таблице Менделеева; строение атома; возможные валентности.
+7N1s22s2p3 Т.к. на внешнем уровне атома азота находятся четыре орбитали, то его максимальная валентность равна IV. Его степени окисления от -3 до +5.
2). Строение молекулы. :N≡N: В молекуле азота тройная связь: 1σ-связь и 2 π-связи. Поэтому молекула азота очень прочная (Е связи =946 кДж/моль).
3). Нахождение в природе. В свободном состоянии азот содержится в воздухе: φ(N2)=78%; ω(N2)=75%; в почве в виде NH4+ и NO3-, в гумусе (органической части почвы).
4). Физические свойства. Азот – газ, без цвета и запаха, чрезвычайно инертный из-за образования тройной связи в молекуле N2. Плохо растворим в воде (в 100V H2O растворяется 1,54V N2 при t0=200С и p = 1 атм); t0кип.=-1960C; t0пл.=-2100C. До настоящего времени очень актуальной является проблема связывания молекулярного азота, которого много в атмосфере, в соединения.
5). Получение.
а) в промышленности азот получают из воздуха фракционной перегонкой;
б) в лаборатории: NH4NO2 →N2↑ + 2H2O (нагревание)
6). Химические свойства.
а) Восстановитель N20  2N+2
2N+2
Азот очень инертен, поэтому реагирует с очень ограниченным числом реагентов:
N2 + O2 = 2NO эта реакция протекает при нагревании (2000-3000ºС) или электрическом разряде.
б) Окислитель N20 → 2N-3 N2 + 3H2 ↔ 2NH3для того, чтобы получить аммиак необходимо повышенное давление (для смещения равновесия вправо), повышенная температура (увеличение скорости реакции) и катализатор (губчатое железо с добавками оксидов калия и алюминия).
При горении на воздухе лития и магния кроме оксидов образуются и нитриды:
6Li + N2 = 2Li3N при комнатной температуре, 3Mg + N2 = Mg3N2. (при нагревании)
Аммиак NH3
Физические свойства
NH3 – бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха. D по воздуху = M(NH3 )/ M ср.воздуха = 17 / 29 = 0,5862 t0 кип.= –33,40C; t0пл.= –780C.
Молекулы аммиака связаны слабыми водородными связями
Благодаря водородным связям, аммиак имеет сравнительно высокие t0кип. и t0пл., а также высокую теплоту испарения, он легко сжимается. Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t0=200C и p=1 атм).
Получение
1. Промышленный способ N2 + 3H2 ↔2NH3
(p=1000 атм; t0= 5000C; kat = Fe + алюмосиликаты; принцип циркуляции).
3. Лабораторный способ. Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2 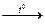 CaCl2 + 2NH3 + 2Н2O
CaCl2 + 2NH3 + 2Н2O
Химические свойства
Образование ковалентной связи по донорно–акцепторному механизму.
I.
1. Раствор аммиака в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из–за образования гидроксида аммония. NH3 + Н2O ↔ NH3∙H2O ↔ NH4+ + OH–
2. Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl →NH4Cl 2NH3 + H2SO4 →(NH4)2SO4
II.
Аммиак – восстановитель (окисляется до N2 или N+2O)
1. Разложение при нагревании 2N–3H3 →N20 + 3H2 (нагревание)
2. Взаимодействие с кислородом:
a) без катализатора 4N–3H3 + 3O2 →2N20 + 6Н2O(горение)
б) каталитическое окисление ( kat = Pt ) 4N–3H3 + 5O2 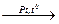 4N+2O + 6Н2O
4N+2O + 6Н2O
3. При нагревании аммиак восстанавливает многие металлы из их оксидов (как водород):
3Cu+2O + 2N–3H3 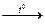 3Cu0 + N20 + 3Н2O
3Cu0 + N20 + 3Н2O
III. 4. Водный раствор аммиака осаждает некоторые металлы в виде гидроксидов:
AlCl3 + 3NH3 + 3H2O = Al(OH)3↓ + 3NH4Cl
CuSO4 + 2NH3 + 2H2O = Cu(OH)2 + (NH4)2SO4
Соли аммония
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства Кристаллические вещества, хорошо растворимые в воде.
Получение Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3  NH4NO3(нитрат аммония)
NH4NO3(нитрат аммония)
2NH4OH + H2SO4  (NH4)2SO4(cульфат аммония) + 2Н2O
(NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl  NH4+ + Cl-
NH4+ + Cl-
2. Разложение при нагревании.
a) если кислота летучая NH4Cl 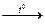 NH3 + HCl NH4HCO3
NH3 + HCl NH4HCO3 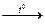 NH3 + Н2O + CO2
NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 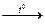 N2O + 2Н2O (NH4)2Cr2O7
N2O + 2Н2O (NH4)2Cr2O7 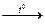 N2 + Cr2O3 + 4Н2O
N2 + Cr2O3 + 4Н2O
3. С кислотами и солями (реакция обмена)
a) (NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2 CO32- + 2H+ →Н2O + CO2
б) (NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4↓ + 2NH4+ + 2NO3- Ba2+ + SO42- → BaSO4↓
4. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH 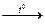 NaCl + NH3 + Н2O
NaCl + NH3 + Н2O
Оксиды азота: N2+1O N+2O N2+3O3 N+4O2 N2+5O5
Оксид азота (I)
N2+1O закись азота, "веселящий газ"
Физические свойства
Газ, бесцветный, запах сладковатый, растворим в воде, t0пл.= -910C, t0кип.= -88,50С. Анестезирующее средство.
Получение NH4NO3 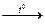 N2O + 2Н2O
N2O + 2Н2O
Химические свойства
1. Разлагается при 7000C с выделением кислорода: 2N2+1O 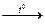 2N20 + O20
2N20 + O20
поэтому он поддерживает горение и является окислителем. Несолеобразующий оксид
Оксид азота (II) N+2O
Газ, бесцветный, плохо растворим в воде, t0пл.= -1640C, t0кип.= -1520С
Получение
1. Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2 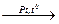 4NO + 6H2O
4NO + 6H2O
2. 3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
3. N2 + O2 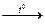 2NO (в природе, во время грозы)
2NO (в природе, во время грозы)
Химические свойства
1. Легко окисляется кислородом.
2NO + O2 →2NO2 Несолеобразующий оксид
Оксид азота (III) N2+3O3
Физические свойства
Темно-синяя жидкость (при низких температурах), t0пл.= -1020C, t0кип.= 3,50С; Выше t0кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение NO2 + NO ↔ N2O3
Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH →2NaNO2(нитрит натрия) + H2O
Оксид азота (IV) N+4O2 диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t0пл.= -11,20C, t0кип.= 210С.
Получение
1. 2NO + O2 → 2NO2
2. Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
1. Кислотный оксид: 4NO2 + 2H2O + O2 → 4HNO3
со щелочами 2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
2. Окислитель N+4O2 + S+4O2 → S+6O3 + N+2O
Оксид азота (V) N2+5O5
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Химические свойства
1. Кислотный оксид N2O5 + H2O → 2HNO3
2. Легко разлагается (при нагревании - со взрывом): 2N2O5 → 4NO2 + O2
Азотистая кислота
HNO2 H–O–N=O
Физические свойства
Существует только в разбавленных водных растворах.
Получение AgNO2 + HCl → HNO2 + AgCl↓
Химические свойства
1. Слабая кислота; ее соли (нитриты) – устойчивы: HNO2 + NaOH → NaNO2 + H2O
Азотная кислота HNO3
Физические свойства Бесцветная жидкость, неограниченно растворимая в воде; t0пл.= -410C; t0кип.= 82,60С, ρ = 1,52 г/см3
Получение
1. Лабораторный способ KNO3 + H2SO4(конц) 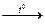 KHSO4 + HNO3
KHSO4 + HNO3
2. Промышленный способ. Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 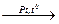 4NO + 6H2O
4NO + 6H2O
б) Окисление кислородом воздуха NO до NO2: 2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O → 4HNO3
Химические свойства
Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
Реагирует:
с основными оксидами CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- → Cu2+ + 2NO3- + H2O или CuO + 2H+ → Cu2+ + H2O
с основаниями HNO3 + NaOH → NaNO3 + H2O H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
или H+ + OH- → H2O
вытесняет слабые кислоты из их солей 2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2 2H+ + СO32- → H2O + CO2
Специфические свойства азотной кислоты
Сильный окислитель
1. Разлагается на свету и при нагревании 4HNO3 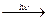 2H2O + 4NO2 + O2
2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 → соль азотной кислоты + вода + газ
в) HNO3 – окислитель.
Продукты восстановления HNO3 зависят от 2-х факторов: силы восстановителя и концентрации кислоты. Чем сильнее восстановитель и чем более разбавлена кислота, тем более низкую степень окисления имеет азот (N) в продуктах восстановления HNO3:
| восстановитель концентрация HNO3 | щелочные и щелочноземельные металлы | тяжелые металлы |
| разбавленная кислота | N–3H4NO3 | N+2O |
| концентрированная кислота | N2+1O | N+4O2 |
HNO3 не взаимодействует с Au, Pt, Ir, Os.
HNO3(конц.) взаимодействует с Al, Cr, Fe ТОЛЬКО при t°
NO3- + 2H+ + 1e → NO2 + H2O, (1)
NO3- + 4H+ + 3e → NO + 2H2O, (2)
2NO3- + 10H+ + 8e → N2O + 5H2O, (3)
2NO3- + 12H+ + 10e → N2 + 6H2O, (4)
NO3- + 10H+ + 8e → NH4+ + 3H2O. (5)
***С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NО2; если НNО3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2)-(5), в зависимости от степени разбавления.
4. С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот: S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O (нагревание)
3P0 + 5HNO3 + 2H2O(разб) →5NO + 3H3P+5O4
| <== предыдущая лекция | | | следующая лекция ==> |
| Чистые инвестиции меньше валовых инвестиций на сумму амортизационных отчислений в отчетном периоде. | | | Момент силы. Момент импульса. |
Дата добавления: 2017-01-29; просмотров: 790;
