ацилпроизводные фенотиазина
1. В отличие от 1-ой подгруппы получены в России
2. Применяются как антиаритмические и антиангинальные средства
Этмозин Aethmozinum
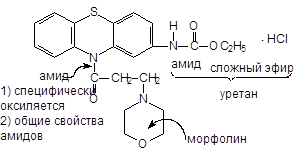
2-карбэтоксиамино-10-(3’-морфолилпропионил)-фенотиазина гидрохлорид
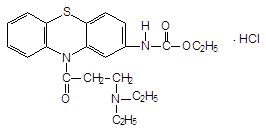
|
Этацизин - Aethacizinum
2-карбэтоксимино-10-(3’-диэтиламинопропионил)-фенотиазина гидрохлорид
Фармакологическое действие
1. Препараты 1 группы - это нейролептики. Исключение: Дипразин - антигистаминное ЛС.
2. Препараты 2-ой группы - антиаритмики, антиангинальные. М.б. антидепрессанты.
3. Основное действие оказывает радикал в положении 10.
Физические свойства: белые кристаллические вещества с оттенком (т.к. очень легко окисляются); без запаха, растворимы в воде (т.к. соли) - реакция среды кислая. Некоторые препараты растворимы в хлороформе. рН =3 - 4 - алкил-производные, рН = 4 - 6 - ацилпр.
Молекула имеет плоское строение. Характеризуются температурой плавления - соли, основания, пикраты. Характерный УФ-спектр (256 и 310 нм), характерный ИК-спектр.
Химические свойства:
1. Все препараты - это соли минеральных кислот и азотсодержащих соединений
2. Очень легко окисляются, т.к. являются соединениями с частично гидрированной структурой за счет тиазина. [Легко окисляются фенолы, ароматические амины, соединения с частично гидрированной структурой - морфин, аскорбиновая к-та, производные пиразола.] - мысли вслух.
3. Ковалентно связанный хлор
4. Остаток минеральной кислоты
5. Ароматическая система
6. Частные реакции.
7. Кислотно-основные свойства: Доказательство соли: 1) растворимы в воде, 2) реакция среды кислая, 3) при добавлении щелочи, аммиака или карбоната натрия - выпадает основание алкалоида.
8. Доказательствоазотсодержащегооснования - с общеалкалоидными реактивами. Препарат растворяют в воде и добавляют реактив:
J2 /КJ = коричневый осадок;
HdJ2 / KJ = белый осадок;
пикриновая к-та = желтый осадок;
BiJ3 / KJ = оранжевый осадок.
Определяют температуру плавления пикратов. Некоторые осадки имеют характерные формы кристаллов (реактив Драгендорфа).
Комплексообразование с PdCl2 - синее окрашивание.
Свойства солей органических оснований применяется в методе количественного определения. Все субстанции - кислотно-основное титрование по общему принципу. Усиливают основные свойства растворителем - лед. CH3COOH.
Аминазин + лед. CH3COOH, Hg(CH3COO)2, + уксусный ангидрид, + муравьиная к-та. Индикатор: кристаллический фиолетовый. Т = HClO4. В Т.Э. à [аминазин]HClO4 - перхлорат.
Дополнительные методы:
A) Алкалиметрия - титруют связанную к-ту.
B) Весовой - основание или препарата взаимодействия с общеалкалоидными реактивами.
C) Определение связанного азота - методом Кьельдаля.
D) Нефелометрия - окрашивают, степень мутности.
E) Экстракционная фотометрия - в ЛФ или биологических жидкостях. Препарат + буфер + кислотный краситель (тропеолин 00), рН = 3 - 4 à добавляют хлороформ. Желтое окрашивание. Определяют оптическую плотность.
9. Окислительно-восстановительные свойства: это основное свойство препаратов в этой группы. Процессы окисления in vivo & in vitro.
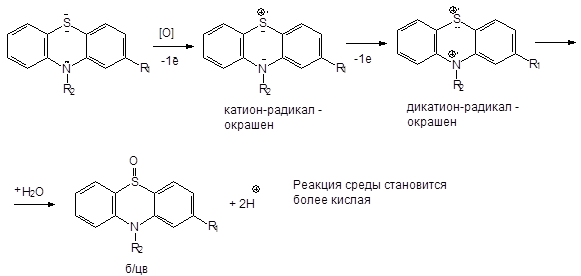
Характерные температуры плавления, ИК, УФ спектры.
Жесткое окисление:
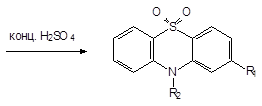
Образуется S-S-диоксид (сульфон) - б/цв - не обладает фармакологическим действием.
Окраска зависит от характера радикала в положении 2 и не зависит от природы окислителя. Если в положении 2 хлор - окрашивание розовое, малиновое; если CF3 - оранжевое.
Окислители: 1) Br2 при нагревании, КBrО3 в кислой среде; 2) конц. H2SO4 ; 3) FeCl3 + H2SO4 ; 4) Се(SO4)2 и др. Реактив FPN (FeCl3 + HClO4 + HNO3).
Специфика окисления ацилпроизводных: т.к. имеется амидная связь (электронакцептор) в положении 10, что затрудняет отдачу электронов, Þ реакции окисления идут трудно. Используют: 1) конц. H2SO4 или гидролиз; 2) HCl при нагревании затем + Br2, КBrО3. Но в 10-ом положении может быть гидроксамовая реакция:
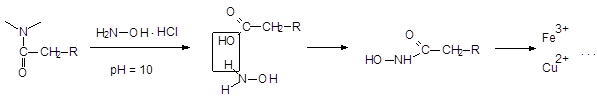
Проводят гидролиз амидной связи и доказательства ищут.
Чистота: 1) рН, т.к. соли; 2) цветность и прозрачность - окисление по сере и азоту; 3) посторонние фенотиазины - полупродукты синтеза - нормируются Þ ТСХ, ВЭЖХ.
К.О. + : 1) Субстанции - Кислотно-основное титрование в неводной среде.
2) ЛФ: УФСФМ, видимая СФМ (с PdCl2 или окислители), экстракционная фотометрия, Цериметрия
3) В биологических жидкостях - ВЭЖХ, флюро-СФМ
Стабилизация ЛФ для инъекций: некоторые ЛФ готовят асептически в токе азота и не стерилизуют температурой. Это раствор Аминазина 2,5%.
Стабилизаторы: аскорбинка, сульфат натрия, метабисульфат натрия.
Ковалентно связанный галоген. Для аминазина - т.к. содержит хлор Þ необходимо выделить основание щелочью. Отмывают до отрицательно реакции на хлорид. Затем переводят ковалентный хлор в хлорид=-ион. Реакция на хлорид: 1) окисление - с кислородом; конц. H2SO4 + HNO3 ; Na2СO3 + КNO3 à Сl-, который открывают с AgNO3.
2) Восстановление: цинковая пыль в HCl или NaOH при нагревании Þ образуется хлорид ион. +AgNO3
3) Так же определяется в фильтрате после выделения основания:
[Препарат]HCl + NaOH Þ основание ¯. + HNO3 , + AgNO3 и так далее...
Частные реакции:
этацизин - не дает гидроксамовой пробы, т.к. в момент гидролиза не дает ацильного остатка:
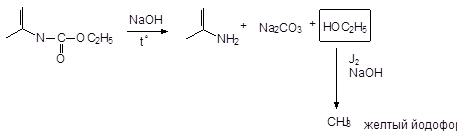
Хранение: список Б, в холодильнике.
Обращение: с осторожностью, в резиновых перчатках. При попадании на кожу - смывают подкисленной водой.
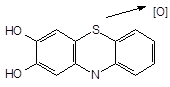
|
Метаболиты:
-образование N-оксидов
-деметилирование, дехлорирование
-гидроксилирование в 3-е положение
-окисление по сере
-образование глюкуранидов
Все метаболиты не активны.
Дата добавления: 2016-11-28; просмотров: 3490;
