Химическое равновесие. Константы равновесия. Смещение равновесий. Принцип Ла-Шателье.
Все реакции делятся на две группы: необратимые и обратимые реакции. Необратимые протекают до конца – до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении, а обратимая – как в прямом, так и обратном направлении.
Химическое равновесие – момент в протекании реакции, когда скорости прямой и обратной реакции становятся одинаковыми. Для обратимой системы оно характеризуется:
· Равенством скоростей прямой и обратной реакций.
· Постоянством концентраций всех реагирующих веществ во времени, а, следовательно, отсутствием видимых изменений.
· Постоянной величиной свободной энергии.
· Величиной константы ХР: 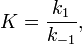 где
где  — константа скорости прямой реакции,
— константа скорости прямой реакции,  — константа скорости обратной реакции.
— константа скорости обратной реакции.
Химическое равновесие называют динамическим равновесием – число частиц, образующихся в единицу времени при прямой реакции, равно числу частиц, вступивших во взаимодействие при обратной реакции.
При равновесии скорости прямой и обратной реакций равны друг другу, при этом в системе устанавливаются постоянные концентрации исходных веществ и продуктов реакции, называемые равновесными концентрациями. Они обозначаются квадратными скобками.
Смещение химического равновесия происходит при изменении различных условий в системе: изменения концентрации какого-либо из веществ, участвующих в реакции, давления или температуры:
· Изменение концентрации: при увеличении концентрации какого-либо из реагирующих веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
· Изменение давления: при увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления, при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
· Изменение температуры: при повышении температуры равновесие смещается в направлении эндотермической, а при понижении – в направлении экзотермической реакции.
Принцип Ла-Шателье:если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Дата добавления: 2016-08-07; просмотров: 585;
