С выработкой электроэнергии в генераторе
Г – генератор; ГТ – газовая турбина;
ХТП – химико-технологический процесс
Альтернативные источники энергии.Традиционные источники энергии (пар, горячие теплоносители, электроэнергия) вырабатываются из топливных ресурсов. Перспективными являются легко возобновляемые и более дешевые источники, такие, например, как атомные станции, солнечная энергия, энергия ветра, приливов и др. Однако, их применение специфично, но в ряде случаев может реально привести к уменьшению расхода в производстве более дефицитных топливных ресурсов.

Замена химической схемы получения продукта – переход к процессу с меньшим числом стадий. Это как правило, сокращает число нагревов и охлаждений потоков, затраты на преодоление гидравлического сопротивления. Это видно на примере производства бутадиена-1,3 (дивинила СН2=СН-СН=СН2). В сложившейся технологии получения этого мономера превалирует способ двухстадийного дегидрирования бутана:
Реакции дегидрирования на обеих стадиях процесса (получение н-бутена и бутилена) – эндотермические, каталитические – протекают с увеличением объема, при повышенных температурах (550-600ºС) и давлении, близком к атмосферному, или в вакууме. Схема двухстадийного получения бутадиена-1,3 приведена на рисунке 4.9 (а). Этот метод отличается сравнительно высоким выходом целевого мономера (65%), но имеет ряд недостатков: необходимость разделения газовых смесей после каждой ступени, повышенные капитальные вложения и энергетические затраты.
В промышленности реализована альтернативная схема синтеза бутадиена-1,3 одностадийным дегидрированием н-бутана. При одностадийном процессе указанные реакции протекают одновременно на катализаторе, который довольно быстро дезактивируется вследствие покрытия его углекислыми отложениями. Возможна активация (регенерация) катализатора путем выжига отложений. Дегидрирование осуществляют под вакуумом (0,05-0,06 МПа) при температуре 580-600ºС в адиабатических реакторах регенеративного типа, в которых циклы дегидрирования и регенерации катализатора чередуются. Соответственно, дегидрирование проходит последовательно в разных реакторах. Схема процесса показана на рисунке 4.9 (б). Рабочий цикл катализатора – короткий (несколько минут). Теплота, выделяемая при регенерации катализатора, аккумулируется им и используется в цикле дегидрирования. Это экономит тепло, затрачиваемое на выход на рабочий цикл и его поддержание. Условием эффективной работы реакторов подобного типа является сбалансированность теплот реакции и регенерации. В зависимости от мощности производства число циклически работающих реакторов в установке составляет 5–8 аппаратов. Все переключения потоков производятся автоматически, благодаря чему создается непрерывный поток исходных веществ и конечных продуктов. Более короткая технологическая схема и сбалансированность теплот отдельных стадий процесса значительно сокращают затраты тепла и энергии.
Примером создания энергоэкономичных схем может служить новая технология преобразования энергии химического взаимодействия в электрическую энергию в так называемых топливных элементах.
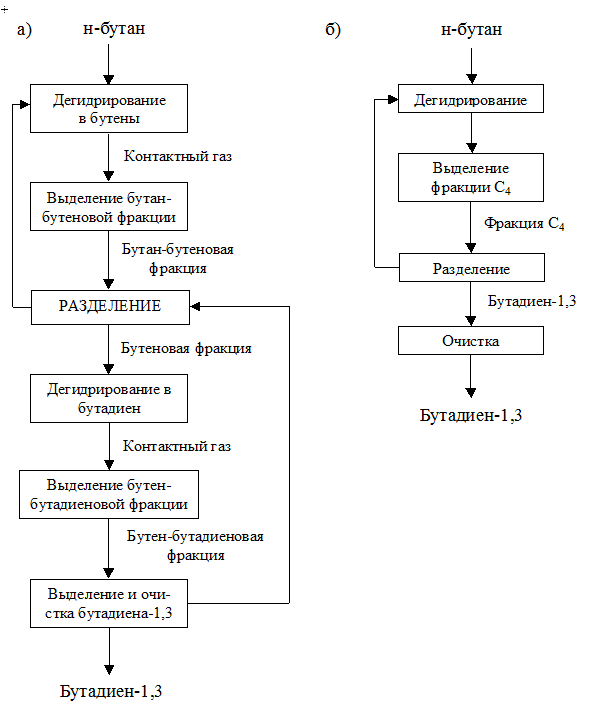 Рисунок 4.9 Поточная схема получения бутадиена – 1,3:
Рисунок 4.9 Поточная схема получения бутадиена – 1,3:
а) двухстадийным дегидрированием н-бутана;
б) одностадийным дегидрированием н-бутана
В топливных элементах осуществляется как бы беспламенное горение особого рода, с пространственным разделением топлива и окислителя и с превращением выделяемой энергии непосредственно в электрический ток. Любая окислительно-восстановительная химическая реакция сопровождается переносом электронов от восстановителя (топлива) к окислителю. В топливном элементе окислитель и топливо (в простейшем случае это газообразные кислород и водород) присоединяют и отдают электроны на поверхности катода и анода. Образующиеся ионы переходят в электролит, разделяющий электроды, и реагируют с образованием воды. На каждый киловатт-час полученной при сжигании кислорода и водорода энергии при 100 %-м КПД выделяется 421 г воды.
КПД такого превращения должен быть гораздо выше, чем при ступенчатом переходе одного вида энергии в другой: тепла сгорания – в механическую энергию пара, а последней – в электрическую. Кроме того, в топливных элементах, как и в других электрохимических ячейках, не действуют ограничения, накладываемые термодинамикой на тепловые машины.
К настоящему времени уже накоплен достаточно большой опыт реализации идеи топливных батарей. В частности, топливные элементы успешно использовались в космической программе «Аполлон» (США) для питания космических аппаратов. Имеется опыт применения топливных элементов на подводных лодках. Создан и прошел опытные испытания автомобиль, работающий на водородвоздушных топливных элементах мощностью 6 кВт параллельно со свинцовыми аккумуляторами.
Многочисленные исследования посвящены использованию углеводородного топлива в топливных элементах, в частности, природного газа. Однако, углеводороды, во-первых, значительно менее активны, чем водород, гидразин или спирты, а во-вторых, электроды покрываются продуктами частичного окисления углеводородов, что мешает их нормальной работе.
Сфера применения топливных элементов может быть расширена и на химическую технологию. Сегодня большой набор многотоннажных продуктов получают при помощи окислительно-восстановительных реакций, сопровождающихся выделением тепла. Примером таких веществ является хлороводород НСl, пентаоксид фосфора P2O5, азотная кислота НNO3. Образующаяся при их получении энергия пропадает. Для топливных элементов эти реагенты были бы бесплатными источниками энергии.
Революционные преобразования в энергетике ожидаются в ближайшие годы за счет реализации концепции так называемой водородной энергетики [26].
Энергетику необходимо перестроить, и для этого нужно выбрать универсальный энергоноситель, в который стало бы выгодно превращать всю или большую часть энергии из других источников – традиционных и альтернативных, возобновляемых и не возобновляемых, крупных и мелких. Этот энергоноситель должен легко и эффективно отдавать свою энергию при получении электричества. Носитель должен быть энергоемким, дешевым и технологичным, удобным в обращении.
Среди претендентов на почетную и ответственную роль такого энергоносителя рассматривались многие химические системы, способные обратимо менять состав, выделяя и поглощая при этом энергию.
Для хранения энергии можно использовать реакцию превращения смеси метана и паров воды в оксид углерода и водород. Эта реакция протекает с поглощением энергии, а смесь газов можно легко передавать по трубам или закачивать в емкости или подземные резервуары для хранения. Обратная реакция протекает на катализаторе и сопровождается выделением тепла, смесь вновь возвращается к исходному состоянию.
Существует множество других систем с обратимыми химическими реакциями, однако лидером среди перспективных энергоносителей по многим показателям оказался водород.
Водород вызвал к себе столь большой интерес специалистов самых различных отраслей знаний, что возникло новое очень широкое направление науки и техники - водородная энергетика. Более того, широкое использование водорода могло бы привести к столь глубокой перестройке, усовершенствованиям в энергетике, на транспорте, в химической и металлургической промышленности, и эти изменения могли бы, как ожидают, затронуть жизнь и быт многих жителей планеты так сильно, что уже появилось понятие «водородная цивилизация».
Следует повторить, что водород – не заменитель первичных источников энергии, а лишь средство, дополняющее их, вторичный источник, энергоноситель.
Развитие концепции водородной энергетики заставило иными глазами взглянуть на существующие и разрабатываемые способы производства энергии. Большие задачи появились у атомной энергетики, особенно у высокотемпературных ядерных реакторов нового поколения. Совершенно по-иному стала выглядеть роль мощных топливных элементов в большой энергетике, поскольку сегодня в них уже достигнуты довольно высокие значения КПД преобразования энергии водорода в электричество. Альтернативные источники энергии, с помощью которых можно получать водород, приобрели дополнительные шансы на ускоренное развитие. По-другому стали оцениваться перспективы химических, металлургических и нефтехимических производств, потребляющих большие количества водорода. На транспорте использованию водорода как топлива стало уделяться значительно больше внимания.
Таким образом, энергетику, в т.ч. в химической промышленности, нужно построить так, чтобы в основе лежал универсальный энергоноситель, в который бы стало выгодно превращать всю или большую часть энергии из других источников – традиционных и альтернативных, возобновляемых или невозобновляемых, крупных и мелких. Этот энергоноситель должен легко и эффективно отдавать свою энергию. Носитель должен быть энергоемким, дешевым и технологичным.
Дата добавления: 2016-06-24; просмотров: 763;
