КРИОВАКУУМНАЯ ТЕХНИКА
Вакуумная техника – прикладная наука, которая изучает получение и сохранение вакуума, технику проведения вакуумных измерений, а также вопросы разработки, конструирования и применения вакуумных систем и их функциональных элементов.
В переводе с латинского "Вакуум" означает пустоту.
Началом научного этапа развития вакуумной техники можно считать 1643г, когда Торричелли впервые измерил атмосферное давление. В 1672 году Отто фон Герике изобретает механический поршневой вакуумный насос с водяным уплотнителем.
Наконец, в 80-х годах 19 века начинается технологический этап создания вакуумных приборов и техники. В этот период начинают изобретаться различные типы вакуумных насосов (вращательный, криосорбционный, молекулярный, диффузионный).
В СССР становление вакуумной техники началось с развития электроники и новых методов физики.
Первые области ее промышленного применения – откачка осветительных электроламп и электровакуумных приборов, но с появлением транзисторов электронная промышленность нашла новое применение вакуумному оборудованию в производстве высокочистых материалов.
Металлургия тоже нашла применение вакуумной технике. Для получения таких металлов, как титан, ниобий, тантал, цирконий, бериллий и их сплавов, необходимо получать разрежение около 10-2…10-4 Па(~ 10-4…10-6мм рт.ст.).
В химической промышленности применение вакуумных сушильных аппаратов позволяет резко увеличить выпуск таких ценнейших материалов, как синтетические волокна, полиэтилен, органические растворители. Искусственные кристаллы алмаза, рубина, сапфира, используемые в квантовых генераторах, создаются с применением вакуумной техники.
В фармацевтической и пищевой промышленности вакуумная техника широко применяется для производства антибиотиков, синтетических гормонов, витаминов, лечебных сывороток и получения многих других ценнейших продуктов.
Консервирование пищевых продуктов с сохранением их вкусовых и питательных свойств.
В легкой промышленности с помощью вакуума получают пластмассы с новыми свойствами, фольгу, бумагу и ткани. Металлизация тканей в вакууме позволяет создавать новые и красивые материалы с высокой отражательной способностью (например, материалы для пожарного оборудования с металлизированной внешней стороной).
В оптической промышленности с помощью напыления тонких слоев в вакууме изготовляют высококачественную оптику, оптические и бытовые алюминированные зеркала.
В строительной промышленности вакуум используется при изготовлении кирпича-сырца методом пластического формования.
В атомной промышленности вакуумная техника позволяет более глубоко изучать строение вещества.
В освоении космоса с достижением сверхвысокого вакуума в камерах имитации космического пространства в условиях земной атмосферы стало возможным изучение космоса.
Понятие о вакууме
Состояние газа, при котором его давление ниже атмосферного (105Па), называется вакуумом. В технике вакуум получают с помощью вакуумных насосов различных принципов действия. При давлениях, близких к атмосферному, вакуум количественно может быть определен как разность
Рвак = Ратм – Рабс,
где Ратм – атмосферное давление, Па;
Рабс- абсолютное давление, Па.
В этих случаях для количественного измерения вакуума используют мановакуумметры.
При абсолютном давлении, отличающемся от атмосферного более чем на два порядка, разность Ратм – Рабс остается практически постоянной и поэтому не может служить количественной характеристикой разреженного газа. В этих условиях вакуум количественно определяется абсолютным давлением газа. При малых давлениях, которые непосредственно уже не могут быть измерены мановакуумметрами, состояние газа может быть охарактеризовано количеством молекул в единице объема, т.е. молекулярной концентрацией.
В этой области давлений основные закономерности течения газов базируются на законах кинетической теории газов, основу которой составляет представление о газе как о совокупности молекул, находящихся в непрерывном движении и взаимодействующих между собой как упругие тела.
Газообразное вещество называется газом, если его температура выше критической; паром – если его температура ниже критической.
В табл.1.1 приведены критические температуры некоторых веществ.
Таблица 1.1
Критические температуры веществ
| Вещество | Критическая температура, 0С | Вещество | Критическая температура, 0С |
| Гелий | – 267,8 | Криптон | – 62,5 |
| Водород | – 241 | Ксенон | +14,7 |
| Неон | – 228 | Двуокись углерода | +31 |
| Азот | – 147 | Вода | +365 |
| Кислород | – 118 | Ртуть | +1450 |
| Аргон | – 122,4 | Железо | +3700 |
Поскольку комнатная температура колеблется в пределах от 15 до 250С, то такие вещества, как гелий, водород, азот, кислород, аргон, криптон следует считать постоянными газами, которые не будут конденсироваться ни при каком сжатии. Такие же газообразные вещества, как ксенон и двуокись углерода, к постоянным газам уже отнести нельзя, так как их критические температуры близки к комнатной. Поскольку вода, ртуть и все металлы имеют достаточно высокие критические температуры, следует говорить только о парах этих веществ.
Степени вакуума
Интенсивность протекания физико-химических процессов в вакууме зависит от соотношения между числом столкновений молекул со стенками сосуда и числом взаимных столкновений молекул, т.е. характеризуется числом Кнудсена (Кn), выражаемого отношением
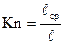 ,
,
где 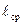 – средняя длина свободного пути молекул;
– средняя длина свободного пути молекул; 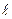 – характерный линейный размер сосуда.
– характерный линейный размер сосуда.
Средняя длина свободного пути молекул 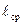 определяется отношением скорости молекул
определяется отношением скорости молекул 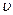 к числу столкновений в единицу времени
к числу столкновений в единицу времени 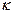 :
:
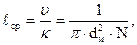
где 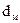 – диаметр молекулы, м;
– диаметр молекулы, м; 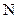 – молекулярная концентрация,
– молекулярная концентрация, 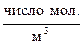 .
.
Из этой формулы следует, 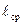 обратно пропорционально молекулярной концентрации и эффективному сечению молекулы, характеризуемому величиной
обратно пропорционально молекулярной концентрации и эффективному сечению молекулы, характеризуемому величиной 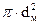 . Кроме того, физически ясно, что
. Кроме того, физически ясно, что 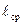 обратно пропорционально давлению
обратно пропорционально давлению 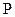 .
.
В зависимости от числа Кнудсена выполнено условное разделение областей вакуума на следующие диапазоны: низкий, средний, высокий и сверхвысокий.
Низкий вакуум соответствует области давлений от 105 до 100 Па
(760 … 1мм. рт. ст.), характеризуется числами Кнудсена 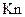 < 5·10-3 и разрежением газа, при котором средняя длина свободного пути частиц во много раз меньше характерного линейного размера
< 5·10-3 и разрежением газа, при котором средняя длина свободного пути частиц во много раз меньше характерного линейного размера 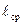 «
« 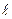 . При этом
. При этом 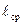 находится в пределах < 6,7·10-5м, концентрация частиц в 1м3 > 2,47·1022, а плотность потока J > 2,98·1024
находится в пределах < 6,7·10-5м, концентрация частиц в 1м3 > 2,47·1022, а плотность потока J > 2,98·1024 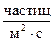 . В условиях низкого вакуума на стенках сосуда постоянно существует адсорбированный слой газа.
. В условиях низкого вакуума на стенках сосуда постоянно существует адсорбированный слой газа.
Средний вакуум соответствует области давлений от 100 до 0,1Па
(1… 10-4мм.рт.ст.), характеризуется числами Кнудсена 5·10-3 < 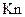 < 1,5 и разрежением газа, при котором средняя длина свободного пути частиц соизмерима с характерным линейным размером
< 1,5 и разрежением газа, при котором средняя длина свободного пути частиц соизмерима с характерным линейным размером 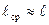 , (
, ( 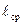 ≈ 6,7·10-5м), при концентрации частиц в 1м3 ≈2,47·1022 и плотности потока J ≈ 2,98·1024
≈ 6,7·10-5м), при концентрации частиц в 1м3 ≈2,47·1022 и плотности потока J ≈ 2,98·1024 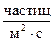 .
.
Высокий вакуум соответствует области давлений от 0,1 до 10-5Па
( 10-4… 10-8мм.рт.ст.), характеризуется числами Кнудсена 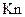 ≥ 1,5 и разрежением газа, при котором средняя длина свободного пути частиц во много раз больше характерного линейного размера
≥ 1,5 и разрежением газа, при котором средняя длина свободного пути частиц во много раз больше характерного линейного размера 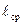 »
» 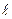 , где
, где 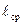 > 6,7·107м, концентрация частиц в 1м3 ≈2,47·1016, а плотность потока J ≈ 2,98·1018
> 6,7·107м, концентрация частиц в 1м3 ≈2,47·1016, а плотность потока J ≈ 2,98·1018 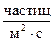 .
.
В случае высокого вакуума ввиду отсутствия взаимных столкновений, путь каждой молекулы представляет прямую линию между двумя точками. Ударившись о стенку и пробыв очень малое время в адсорбированном состоянии, молекула отрывается, т.е. часть стенки освобождается от адсорбированного газа.
Сверхвысокий вакуум соответствует области давлений меньших 10-5Па (и меньших 10-8мм.рт.ст.), характеризуется числами Кнудсена 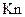 »1,5 и разрежением газа, где также
»1,5 и разрежением газа, где также 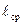 »
» 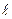 при котором не происходит заметного изменения свойств поверхности, первоначально свободной от адсорбированного газа. Сверхвысокий вакуум характеризуется очень низкими значениями концентраций молекул газа, когда средняя длина свободного пробега оценивается десятками тысяч метров т.е.
при котором не происходит заметного изменения свойств поверхности, первоначально свободной от адсорбированного газа. Сверхвысокий вакуум характеризуется очень низкими значениями концентраций молекул газа, когда средняя длина свободного пробега оценивается десятками тысяч метров т.е. 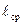 » 6,7·107м, концентрацией частиц в 1м3 ~2,47·1010 и плотностью потока J ~ 2,98·1012
» 6,7·107м, концентрацией частиц в 1м3 ~2,47·1010 и плотностью потока J ~ 2,98·1012 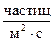 .
.
Нижний предел, достигаемых в настоящее время разрежений составляет ~ 10-14мм.рт.ст.
ЛЕКЦИЯ №2
Основой физики вакуума являются следующие постулаты молекулярно-кинетической теории газа:
1) газ состоит из отдельных движущихся молекул;
2) существует постоянное распределение молекул газа по скоростям, т.е. одной и той же скоростью обладает всегда одинаковое количество молекул;
3) при движении молекул газа нет преимущественных направлений;
4) температура газа – величина пропорциональная средней кинетической энергии его молекул;
5) при взаимодействии с поверхностью твердого тела молекула газа адсорбируется.
Состояние газа определяется следующими тремя параметрами: абсолютным давлением, абсолютной температурой и удельным объемом (плотностью). Для решения многих задач, возникающих при изучении процессов, используют понятие идеального газа.
Идеальными принято считать такие газы, у которых:
· молекулы можно представить как упругие материальные частицы;
· силы межмолекулярного взаимодействия отсутствуют(происходят лишь упругие столкновения между молекулами);
· объем, занимаемый собственно молекулами, мал по сравнению с объемом, свободным от молекул.
Разреженные газы, с которыми в основном имеет дело вакуумная техника, по своим свойствам очень мало отличаются от идеальных газов.
Дата добавления: 2016-02-11; просмотров: 1051;
