Окислительное декарбоксилирование пирувата
Основная масса АТФ получается путём окисления пирувата в цикле Кребса. Во время этого процесса образуется НАДН и ФАД*Н2, которые используются в процессе окислительного фосфорилирования.
Судьба пирувата зависит от энергетического состояния клетки. В клетках с высоким энергетическим состоянием пируват идёт на глюконеогенез. Если в клетке энергетическое состояние низкое, то пируват окисляется до Н2О и СО2 в цикле Кребса с образованием 15 моль АТФ.
Ферменты цикла Кребса, как и ферменты окислительного фосфорилирования, локализованы в митохондрии. Когда пируват попал в митохондрию, то на него действует либо фермент глюконеогенеза пируваткарбоксилаза либо первый фермент пируватдегидрогеназного комплекса пируват дегидрогеназа. В клетке с высоким энергетическим состоянием (где много КоА ацилировано до ацетил-КоА), аллостерически активируется (активатором является сам ацетил-КоА) пируват карбоксилаза, направляя пируват на глюконеогенез. В клетке с низким энергитическим состоянием, где КоА ацилировано мало, пируват карбоксилаза не активна и пируват идёт через пируватдегидрогеназный комплекс.
Пируватдегидрогеназный комплекс включает в себя три фермента:
-пируватдегидрогеназа
-дигидролипоил трансацетилаза
-дигидролипоил дегидрогеназа.
Пируватдегидрогеназный комплекс использует также 5 коферментов: КоА, НАД+, ФАД+,липоевая кислота и ТПФ.
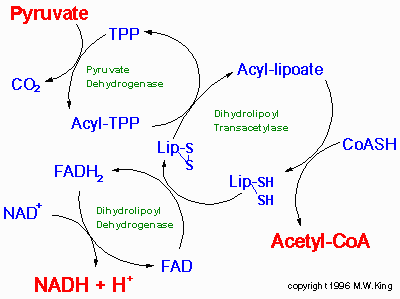
Во время первой реакции ацетильная группа, которая получилась при декарбоксилировании, связывается с ТПФ. Следующая реакция - перено ацетильной грууппы с ацетил-ТПФ (оксиэтил-ТПФ) на липоевую кислоту, которая ковалентно связана с ферментом дигидролипоил трансацетилазой. Затем ацетильная группа переносится на КоА-SH. При этом образуется дигидролипоамид с двумя SH-группами. Вместе с превращением ЛК-(SH)2 в ЛК-SS ФАД превращается в ФАД*Н2, который связан с дигидролипоилДГ.
Регуляция
Реакции пируватдегидрогеназного комплекса служат для взаимосвязи гликолиза, глюконеогенеза и синтеза ЖК с циклом Кребса.
1).Ингибирование конечными продуктами - ацетилКоА и НАДН.
2).Ковалентная модификация фосфорилирование/дефосфорилирование.
Киназа - активируется при увеличенииНАДН/НАД+,
- ингибируется соотношением АДФ/АТФ.
Фосфатаза -активируется инсулином (в клетках жировой ткани).
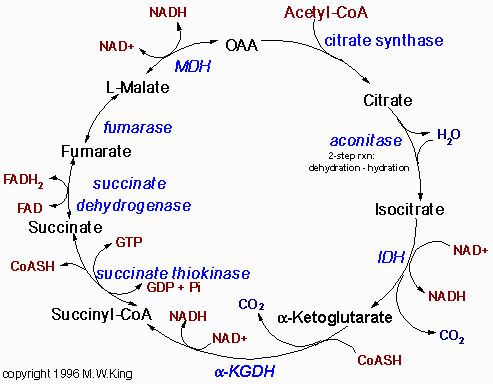
Цитратсинтаза.
Первая реакция цикла - это конденсирование ацетилКоА и ЩУК. При этом продуктом реакции является цитрат. Кроме того, цитрат используется в транспорте ацетилКоА из митохондрии в цитоплазму, где он используется на синтез ЖК и холестерола. В дополнение надо сказать, что цитрат в цитоплазме активирует ацетилКоАкарбоксилазу, первый фермент синтеза ЖК, и ингибирует фосфофруктокиназу-1. Во внепечёночных тканях цитрат также требуется для синтеза кетоновых тел.
Аконитаза.
Изомеризация цитрата в изоцитрат посредством аконитазы - стереоспецифична, с миграцией ОН-группы от центрального углеродного атома на соседний. Аконитза - один из нескольких митохондриальных ферментов, которые в своём составе содержат негемовое железо.
Изоцитратдегидрогеназа (ИДГ).
Изоцитрат окислительно декарбоксилируется до альфа-кетоглутарата посредством фермента ИДГ. Известно два различных фермента ИДГ. ИДГ, который используется в цикле Кребса, как кофактор использует НАД+, в то время как другая ИДГ использует НАДФ+ как кофактор. Первый фермент обнаружен только в митохондриях, а второй - как в митохондрии, так и в цитоплазме. СО2, который образуется в этой реакции, идёт на синтез цитрата.
Альфа-кетоглутаратДГ.
Альфа-кетоглутарат декарбоксилируется до сукцинилКоА с помощью альфа-кетоглутаратДГ. В ходе этой реакции образуется второй моль СО2.
СукцинилКоАсинтетаза.
Катализирует реакцию превращения сукцинилКоА в сукцинат. При этом из ГДФ образуется ГТФ, процесс такой известен как субстратное фосфорилирование.
СукцинатДГ.
СукцинатДГ катализирует реакцию окисление сукцината в фумарат с последующим восстановлением ФАД.
Фумараза.
Под действием этого фермента образуется L-малат.
МалатДГ.
L-малат - специфический субстрат для МДГ, последнего фермента цикла Кребса. При этом происходит окисление малат в ЩУК с последующим восстановлением НАД+.
Глюконеогенез
Глюконеогенез - синтез глюкозы из неуглеводных предшественников. Глюконеогенез необходим в мозге, яичках, эритроцитах и мозговом веществе почек, где глюкоза является единственным источником энергии. Однако, во время голодания мозг может получать энергию из кетоновых тел, которые превращаются в ацетилКоА.
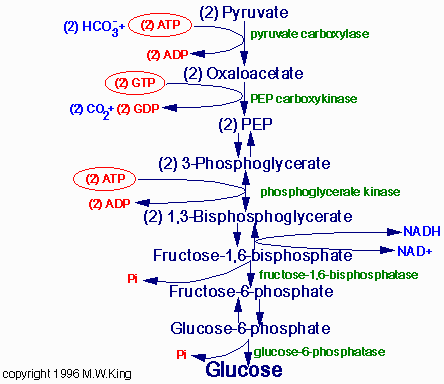
Первоначально пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата (ЩУК).
Пируваткарбоксилаза находится в митохондриях. Мембрана митохондрий непроницаема для образовавшегося ЩУКа. Последний здесь же в митохондриях восстанавливается в малат.
Реакция протекает при участии митохондриальной НАД-зависимой малатдегидрогеназы. В митохондриях отношение НАДН2/НАД+ относительно высоко, и поэтому внутримитохондриальный ЩУК легко восстанавливается в малат, который легко выходит из митохондрии, проходя мембрану митохондрий. В цитоплазме же отношение НАДН2/НАД+ очень мало, и малат вновь окисляется в ЩУК при участии НАД-зависимой цитоплазматической малатдегидрогеназы.
Субстраты глюконеогенеза
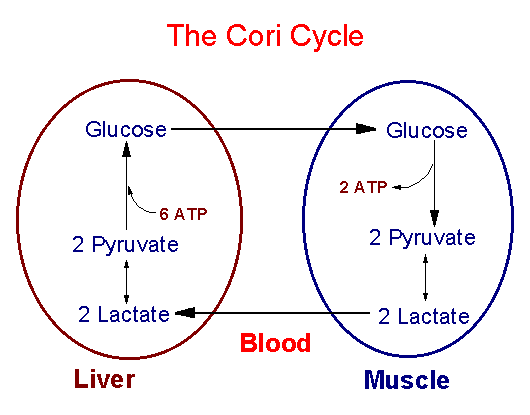
Лактат - образуется в процессе анаэробного гликолиза в эритроцитах и клетках скелетных мышц. Превращение лактата в глюкозу происходитв результате работы цикла Кори. Значение - с участием цикла Кори конечные продукты гликолиза из эритроцитов и скелетных мышц транспортируется в печень и используются на синтез глюкозы.
Аланин - основная глюкогенная аминокислота. Превращение аланина в глюкозу происходит в аланиновом цикле. В скелетных мышцах пируват, образующий в ходе гликолиза, может превращаться в аланин. Аланин, образующийся в этих реакциях, является транспортной формой NH2-групп из мышц в печень, где они в конечном счёте включаются в молекулы мочевины и экскретируются. При поступлении аланина в гепатоциты он может превращаться в пируват и использоваться как субстрат в глюконеогенезе. Значение - Аммиак является чрезвычайно токсическим соединением и основное его количество обезвреживается в клетках печени (в орнитиновом цикле происходит связывание его в молекулу мочевины и затем экскреция). Аланин служит транспортной формой аммиака в печень, где осуществляется его обезвреживание.
Другие аминокислоты. Только две аминокислоты (лейцин и лизин) не могут использоваться в процессе глюконеогенеза. Это строго кетогенные аминокислоты. Все остальные глюкогенные аминокислоты при своём метаболизме дают промежуточные продукты гликолиза или цикла Кребса.
Глицерол. Образуется при катаболизме триацилглицеролов в клетках жировой ткани, выходит в кровь и затем попадает в печень, где под действием двух ферментов (глицеролкиназа и альфа-глицеролфосфатдегидрогеназа) превращается в фосфодиоксиацетон (ФДА), промежуточный продукт гликолиза.
Пропионил-КоА. Бетта-окисление ЖК с нечётным числом атомов углерода и метаболизм некоторых аминокислот (валин, изолейцин, триптофан, метионин) сопровождается образованием пропионил-КоА, который может быть превращён в сукцинил-КоА (метаболит цикла Кребса) под действием двух ферментов:
-пропионил-КоА-карбоксилаза (в качестве кофермента используется биотин - смотри витамин Н).
-метилмалонил-КоА-мутаза (метилкобаламин в качестве кофермента - смотри витамин В12).
Суммарное уравнение:
2ПВК + 4АТФ + 2ГТФ + 2НАДН + 2Н+ + 6Н2О = глюкоза + 4АДФ + 2ГДФ + 6Ф + 2НАД+
На синтез молекулы глюкозы из двух молекул пирувата расходуется 4АТФ и 2ГТФ. Процесс окисления ЖК поставляет энергию для глюконеогенеза. Для восстановительных этапов требуется две молекулы НАДН.
Пируваткарбоксилаза, катализирующая первую реакцию, имеет аллостерического активатора - ацетилКоА.
Регуляция глюконеогенеза
1).Репрессируется после приёма богатой углеводами пищи (под действием инсулина) и индуцируется при голодании, стрессе, диабете (под действием глюкокортикоидов).
2).Процесс окисления ЖК стимулирует глюконеогенез. Стимуляция осуществляется через увеличение уровня ацетил-КоА.
3).Реципрокная взаимосвязь:
-ацетилКоА ингибирует пируватДГ и активирует пируваткарбоксилазу.
-АТФ активирует фруктозодифосфатазу, АМФ - ингибирует.
-фруктозо-2,6-дифосфат активирует фосфофруктокиназу-1 и ингибирует фруктозодифосфатазу-1.
Пентозофосфатный путь
Значение пентозофосфатного пути (ПФП):
1).Образуется НАДФН*Н+ (50% всей потребности организма), который используется в востановительных реакциях биосинтеза веществ, в реакциях микросомального окисления и как антиоксидант.
2).Снабжает клетку рибозо-5-фосфатом, который используется для синтеза нуклеотидов и нуклеиновых кислот.
Большое количество НАДФН*Н+ используется для синтеза жирных кислот, холестерола, желчных кислот и стероидных гормонов, поэтому в клетках печени, жировой ткани, лактирующей молочной железе имеется высокий уровень ферментов для ПФП.
Кроме того, эритроциты используют ПФП для получения большого количества НАДФН*Н+, который используется в восстановлении глутатиона.
Превращение рибонуклеотидов в дезоксирибонуклеотиды через активацию рибонуклеотид редуктазы (смотри синтез нуклеотидов) требует НАДФН*Н+ как источник электронов. Следовательно, в быстро пролиферирующих клетках необходимо большое количество НАДФН*Н+.
Превращение углеводов по ПФП не требует присутствия О2.
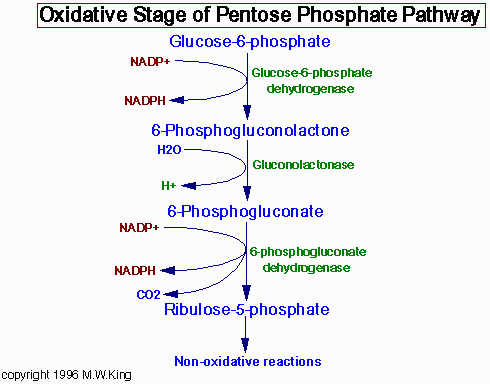
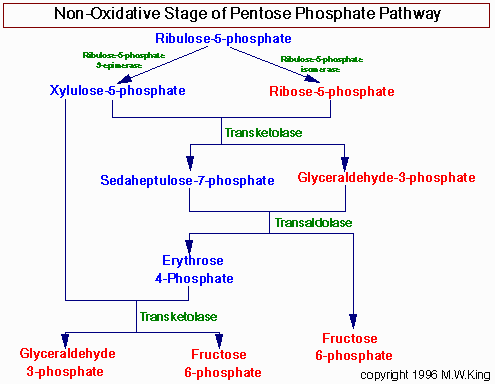
Реакции ПФП идут исключительно в цитоплазме.
Окислительный этап главным образом предназначен для синтеза НАДФН*Н+.
Неокислительный этап ПФП предназначен главным образом для получения рибозо-5-фосфата. Также на этом этапе идёт превращение 5-углеродных сахаров в 6-и (фруктозо-6-фосфат) и 3-углеродные (3-ФГА) сахара, которые могут быть использованы в гликолизе.
Основные ферменты неокислительного этапа - это трансальдолаза и транскетолаза:
-транскетолаза переносит 2х-углеродные группы (для этого требуется тиамин пирофосфат как кофактор - смотри витамин В1.
-трансальдолаза переносит 3х-углеродные группы.
Трансальдолазные и транскетолазные реакции обратимы.
В конечном счёте 3 моля 5-углеродных сахара превращаются в 2 моля 6-углеродных и 1 моль 3-углеродных. Следовательно, 6 моль 5-углеродных сахара превращаются в 4 моля 6-угл. и 2 моля 3-угл. Но 2 моля 3-угл. - это 1 моль 6-угл., поэтому в сумме получается 5 моль 6-угл.
Общая реакция:
6 Гл-6-ф + 7Н2О + 12НАДФ+ = 5 Гл-6-ф + 6СО2 + 12 НАДФН*Н+ + 12Н+ + Фн
Значение неокислительного этапа:
-стабилизирует концентрацию фосфопентоз в клетке;
-синтез фосфопентоз в клетке при тормржении окислительного этапа.
Регуляция
Уровень регуляции - глюкозо-6-фосфат дегидрогеназы.
1). Регуляция активности:
-изостерический ингибитор - НАДФН*Н+. Ингибирование снимается окислительным глутатионом.
-аллостерический ингибитор - ацилКоА.
-простагландины стимулируют активность ДГ окислительного этапа.
2). Регуляция количества фермента:
-инсулин стимулирует синтез.
Эритроциты и ПФП
Всего 3 пути обмена углеводов в эритроцитах:
1).Гликолиз
2).ПФП
3).Метаболизм 2,3-дифосфоглицерата.
Гликолиз снабжает эритроциты энергией АТФ для мембранных насосов и НАДНЧН+ для реокисления метгемоглобина ( Fe2+ = Fe3+).
ПФП снабжает эритроциты НАДФН*Н+ для поддержание уровня глутатиона. Невозможность поддерживать уровень глутатиона в эритроцитах ведёт к ослаблению клеточной стенки и гемолизу. Глутатион удаляет Н2О2 через активность глутатион пероксидазы.
2,3-дифосфоглицерат взаимодействует с гемоглобином, при этом понижается его сродство к О2.
Дата добавления: 2016-02-24; просмотров: 2480;
