Характеристика энергетического состояния электрона системой квантовых чисел. Принцип минимума энергии. Принцип Паули. Правило Хунда.
В одномерной модели атома энергия электрона может принимать только определенные значения, иначе говоря — она квантована. Энергия электрона в реальном атоме также величина квантованная. Возможные энергетические состояния электрона в атоме определяются величиной главного квантового числа п, которое может принимать положительные целочисленные значения: 1, 2, 3... и т. д. Наименьшей энергией электрон обладает при п = 1; с увеличением п. энергия электрона возрастает. Поэтому состояние электрона, характеризующееся определенные значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме: при n = 1 электрон находится на первом энергетическом уровне, при n = 2 на втором и т. д. Главное квантовое число определяет и размеры электронного облака. Для того чтобы увеличить размеры электронного облака, нужно часть его удалить на большее расстояние от ядра. Произвольной не может быть и форма электронного облака. Она определяется орбитальным квантовым числом (его называют также побочным или азимутальным), которое может принимать целочисленные значения от 0 до (п — 1), где п — главное квантовое число. Различным значениям п отвечает разное число возможных значений . Так, при я = 1 возможно только одно значение; орбитального квантового числа —• нуль (/ = 0), при п= 2 l может быть равным 0 или 1, при я = 3 возможны значения /, равные О, 1 и 2; вообще, данному значению главного квантового числа п соответствуют празличных возможных значений орбитального квантового числа. Из уравнения Шредингера следует, что, и ориентация электронного облака в пространстве не может быть произвольной: она определяется значением третьего, так называемого магнитного квантового числа т.п. Магнитное квантовое число может принимать любые целочисленные значения, — как положительные, так и отрицательные, в пределах от + L до - L. Таким образом, для разных значений число возможных значений m различно. Так, для s-электронов (l= 0} возможно только одно значение т (m- 0); для p-электронов (L=1) возможны три различных значения т. Помимо квантовых чисел п, I и т, электрон характеризуется еще одной квантованной величиной, не связанной с. движением электрона вокруг ядра, а определяющей его собственное состояние. Эта величина получила название спинового квантового числа или просто спина; спин обычно обозначают буквой S. Спин электрона может иметь только два значения. Таким образом, как и в случае остальных квантовых чисел, возможные значения спинового квантового числа различаются на единицу.
Заселение атомных орбиталей электронами определяется правилом минимума энергии, принципомПаули и правилом Хунда.
Электроны заселяют атомные орбитали, начиная с подуровня с меньшей энергией. В этом состоит правило минимума энергии. Последовательность в нарастании энергии подуровней акова: 1s < 2s < 2p < 3s < 3p < 4s ≤ 3d < 4p < 5s и так далее …
Согласно расчетам, электрон движется не по какой-то определенной траектории, а может находиться в любой части околоядерного пространства - т.е. можно говорить лишь о вероятности (возможности) его нахождения на определенном расстоянии от ядра.
Электроны в атоме занимают самые энергетически выгодные атомные орбитали (орбитали с минимальной энергией), образуя электронные облака определенной формы.
В случае s-орбитали электронное облако сферическое:
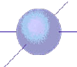 В случае p-орбиталей форма электронного облака гантелеобразная:
В случае p-орбиталей форма электронного облака гантелеобразная:  ...
...
Внутри атомных орбиталей вероятность нахождения электронов велика; иными словами, имеется высокая электронная плотность. Пространство вне объема орбиталей соответствует малой электронной плотности.
В каждой атомной орбитали может размещаться максимально два электрона (принцип Паули).
При наличии орбиталей с одинаковой энергией (например, трех р-орбиталей одного подуровня) каждая орбиталь заполняется вначале наполовину (и поэтому на р-подуровне не может быть более трех неспаренных электронов), а затем уже полностью, с образованием электронных пар (правило Хунда).
Для изображения электронной конфигурации атома нужно распределить его электроны по подуровням так, чтобы каждой атомной орбитали соответствовала одна квантовая ячейка, и в соответствии с тремя указанными правилами заселения.
Дата добавления: 2016-01-16; просмотров: 2998;
