Соли меди в присутствии HCl окрашивают пламя в зелёный цвет.
Чистота
1. Прозрачность раствора. Раствор 0,5 г препарата в 10 мл воды должен быть прозрачным.
2. допустимое содержание примесей: хлоридов, железа и других солей металлов, не осаждённых сероводородом.
Количественное определение
1.ФС Йодометрический метод. Способ титрования – косвенный.
Основан на окислительных свойствах меди (II) сульфата, который окисляет калия йодид до свободного йода, а ион меди (II) восстанавливается до иона меди (I)избытком KI через промежуточный продукт – йодид меди (II).
Образовавшийся CuI2 тут же разлагается с выделением эквивалентного количества CuI йодид меди (I) и йода. Йод оттитровывают Na2S2O3, индикатор – крахмал (добавляют в конце тирования при желтом окрашивании раствора).
В этой реакции (образования CuI и I2) равновесие смещено вправо, т. к. йодид служит не только восстановителем (Cu2++e→Cu+), но и осадителем Cu+.
2CuSO4+4KI → 2CuI2+2K2SO4
2CuI2 → 2CuI↓+I2
осадок белого цвета
Суммарно
2CuSO4 + 4KI → I2 + 2Cul↓+ 2K2SO4
I2+2Na2S2O3 → 2NaI+Na2S4O6
На 2 молекулы CuSO4→ 1молекула I2→2 молекулы Na2S2O3
Кстех = 2моль CuSO4 = 1 fэкв.=1 ·1(РЧ)
2моль Na2S2O3 М. э=М. м.
Т = Ст-та · М.э С% = V· К· T· 100 %
А 1000
Допустимые пределы количественного содержания – 98% и 101% - предел выветривания.
2. Комплексонометрический метод. Прямое титрование в среде ацетатного буфера, индикатор - ксиленоловый оранжевый (см.висмут).
F 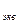 (меди (II) сульфата)=1
(меди (II) сульфата)=1
Дата добавления: 2015-09-07; просмотров: 1281;
