Кристаллы. Связи между атомами и молекулами в твердых телах
Каждая частица в кристаллической решетке (ион, атом или молекула) испытывает силы межмолекулярного взаимодействия. Равновесное расположение всех частиц твердого тела в узлах кристаллической решетки соответствует минимуму свободной энергии кристалла и наиболее устойчивому его состоянию. При этом частицы в узлах решетки располагаются на некоторых равновесных расстояниях 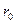 друг от друга, называемых периодом кристаллической решетки.
друг от друга, называемых периодом кристаллической решетки.
 В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают следующие четыре типа решеток: ионную, атомную, молекулярную и металлическую.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают следующие четыре типа решеток: ионную, атомную, молекулярную и металлическую.
 В узлах ионной решетки чередуются отрицательные и положительные ионы. Благодаря электрическим взаимодействиям они образуют устойчивую структуру кристалла. Подавляющее большинство кристаллов имеют именно ионную решетку. Типичным примером ионной решетки является изображенная на рис. 35.1 решетка каменной соли
В узлах ионной решетки чередуются отрицательные и положительные ионы. Благодаря электрическим взаимодействиям они образуют устойчивую структуру кристалла. Подавляющее большинство кристаллов имеют именно ионную решетку. Типичным примером ионной решетки является изображенная на рис. 35.1 решетка каменной соли 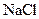 . В ней чередуются ионы
. В ней чередуются ионы 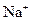 и
и 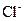 . В газообразном состоянии хлористый натрий состоит из молекул, в которых объединены попарно ионы натрия с ионами хлора. В кристалле молекулы утрачивают обособленное существование. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
. В газообразном состоянии хлористый натрий состоит из молекул, в которых объединены попарно ионы натрия с ионами хлора. В кристалле молекулы утрачивают обособленное существование. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
В узлах молекулярной решетки (см. рис. 35.2) размещаются полярные молекулы. Разноименно заряженные частицы двух соседних молекул притягиваются и связывают молекулы в кристаллическую решетку. Таким образом, между молекулами кристалла действуют те же силы, что и между молекулами реального газа. Эти силы называют еще силами Ван-дер-Ваальса. По сравнению с ионными, молекулярные решетки не такие прочные, они легко деформируются. Такие решетки имеют вода (лед), углекислота (сухой лед), азот, кислород, водород, а также резина, парафин, целлюлоза и многие другие кристаллы.
В атомных решетках нейтральные атомы соседних узлов связаны между собой валентными электронами. Орбиты электронов смещаются так, что электрон движется по орбите, охватывающей два соседних атома, и таким образом, связывает их между собой. Так осуществляется связь атомов в молекулах с ковалентной связью.
 В качестве примера рассмотрим атомные решетки алмаза и графита. Эти кристаллы идентичны по своей химической природе – они построены из атомов углерода, но отличаются строением решетки. В кристалле алмаза (см. рис. 35.3) соседние атомы углерода размещены на одинаковом расстоянии 154 пм друг от друга. Они одинаково и очень тесно связаны во всех направлениях, что является причиной чрезвычайной прочности и твердости алмаза. Каждый четырехвалентный атом углерода размещается в центре правильной четырехгранной пирамиды – тетраэдра, в вершинах которой находятся четыре его ближайших соседа, с которыми он связан валентной связью. Такую же решетку, как у алмаза, имеют типичные полупроводники – германий
В качестве примера рассмотрим атомные решетки алмаза и графита. Эти кристаллы идентичны по своей химической природе – они построены из атомов углерода, но отличаются строением решетки. В кристалле алмаза (см. рис. 35.3) соседние атомы углерода размещены на одинаковом расстоянии 154 пм друг от друга. Они одинаково и очень тесно связаны во всех направлениях, что является причиной чрезвычайной прочности и твердости алмаза. Каждый четырехвалентный атом углерода размещается в центре правильной четырехгранной пирамиды – тетраэдра, в вершинах которой находятся четыре его ближайших соседа, с которыми он связан валентной связью. Такую же решетку, как у алмаза, имеют типичные полупроводники – германий 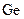 и кремний
и кремний 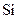 .
.
 Кристаллическая решетка графита (см. рис. 35.4) имеет совершенно другое строение. Она состоит из ряда параллельных слоев атомов. Каждый слой заполнен тесно связанными между собой атомами углерода, размещенными в вершинах правильного шестиугольника на расстоянии 142 пм друг от друга. Между соседними атомами, лежащими в одном слое, осуществляется прочная валентная связь Атомы соседних слоев слабо связаны друг с другом, так как расстояние между соседними слоями более чем вдвое превышает расстояние между атомами шестиугольника и равняется 340 пм. В этом направлении связь осуществляется слабыми силами Ван-дер-Ваальса. Поэтому кристалл графита легко скалывается вдоль этих слоев (плоскостей спайности), он мягок и легко крошится. Это позволяет изготовлять из графита грифели карандашей, щетки электродвигателей, сухие смазки, используемые, например, для уменьшения трения между листами рессоры автомобиля. Поскольку лишь три валентных электрона атома углерода из четырех принимают участие в образовании валентных связей с соседними атомами, четвертый электрон оказывается слабо связанным с атомом. Именно такие электроны обеспечивают электропроводность графита, тогда как алмаз не является проводником электрического тока.
Кристаллическая решетка графита (см. рис. 35.4) имеет совершенно другое строение. Она состоит из ряда параллельных слоев атомов. Каждый слой заполнен тесно связанными между собой атомами углерода, размещенными в вершинах правильного шестиугольника на расстоянии 142 пм друг от друга. Между соседними атомами, лежащими в одном слое, осуществляется прочная валентная связь Атомы соседних слоев слабо связаны друг с другом, так как расстояние между соседними слоями более чем вдвое превышает расстояние между атомами шестиугольника и равняется 340 пм. В этом направлении связь осуществляется слабыми силами Ван-дер-Ваальса. Поэтому кристалл графита легко скалывается вдоль этих слоев (плоскостей спайности), он мягок и легко крошится. Это позволяет изготовлять из графита грифели карандашей, щетки электродвигателей, сухие смазки, используемые, например, для уменьшения трения между листами рессоры автомобиля. Поскольку лишь три валентных электрона атома углерода из четырех принимают участие в образовании валентных связей с соседними атомами, четвертый электрон оказывается слабо связанным с атомом. Именно такие электроны обеспечивают электропроводность графита, тогда как алмаз не является проводником электрического тока.
 В узлах металлической решетки (см. рис. 35.5) размещены положительные ионы металла. В пространстве между узлами решетки двигаются свободные (точнее – коллективизированные) электроны. Эти электроны не принадлежат отдельным атомам, а движутся по сложным орбитам, охватывающим весь металл. Таким образом, междоузельное пространство заполнено своеобразным “электронным газом”, который стягивает, “склеивает” положительные ионы в плотную кристаллическую решетку. Наличием свободных электронов объясняется хорошая электропроводность металлов.
В узлах металлической решетки (см. рис. 35.5) размещены положительные ионы металла. В пространстве между узлами решетки двигаются свободные (точнее – коллективизированные) электроны. Эти электроны не принадлежат отдельным атомам, а движутся по сложным орбитам, охватывающим весь металл. Таким образом, междоузельное пространство заполнено своеобразным “электронным газом”, который стягивает, “склеивает” положительные ионы в плотную кристаллическую решетку. Наличием свободных электронов объясняется хорошая электропроводность металлов.
Дата добавления: 2015-10-05; просмотров: 939;
