Э Н Т Р О П И Я
Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной.
Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
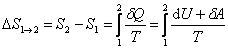 . .
| (6.2.1) |
Таким образом, по формуле (6.2.1) можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий.
Исходя из этого, найдем изменения энтропии в процессах идеального газа.
Так как при Т = const,
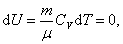 , ,
|
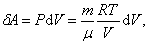 , ,
|
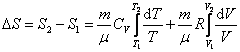 , или , или
|
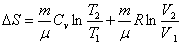 . .
| (6.2.2) |
Таким образом, изменение энтропии ΔS1-2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида перехода 1 - 2.
Каждый из изопроцессов идеального газа характеризуется своим изменением энтропии, а именно:
- изохорический:
 , т.к.
, т.к. 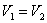 ;
; - изобарический:
 т.к. Р1 = Р2;
т.к. Р1 = Р2; - изотермический:
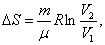 т.к.
т.к. 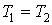 ;
; - адиабатический:
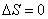 , т.к.
, т.к. 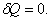
Отметим, что в последнем случае адиабатический процесс называют изоэнтропийным процессом, т.к. 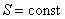 .
.
В изолированных системах самопроизвольно могут протекать только процессы, сопровождающиеся увеличением энтропии.
Энтропия изолированной системы не может самопроизвольно убывать.
Оба этих вывода также являются формулировками второго начала термодинамики.
Дата добавления: 2015-10-05; просмотров: 744;
