Адсорбция на границе жидкость – газ
6.1. Теоретические основы адсорбции
На создание любой поверхности раздела фаз затрачивается определенная работа. Такая работа, производимая над системой, приведет к появлению свободной поверхностной энергии Гиббса G(s):
G(s) = s S (6.1)
где S – площадь поверхности раздела фаз, м2; s- удельная поверхностная энергия или свободная энергия единицы поверхности, 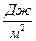 . Величина s зависит от cил взаимодействия между молекулами, находящимися на поверхности раздела фаз. Чем больше эти силы, тем больше величина s. Силы взаимодействия, в основном, зависят от полярности молекул.Чем полярнее молекулы (чем больше их дипольный момент), тем сильнее они взаимодействуют друг с другом и тем выше значение s.
. Величина s зависит от cил взаимодействия между молекулами, находящимися на поверхности раздела фаз. Чем больше эти силы, тем больше величина s. Силы взаимодействия, в основном, зависят от полярности молекул.Чем полярнее молекулы (чем больше их дипольный момент), тем сильнее они взаимодействуют друг с другом и тем выше значение s.
В соответствии со вторым началом термодинамики система стремится уменьшить эту энергию за счет самопроизвольных процессов, протекающих в ней.
Для растворов, состоящих из двух или нескольких веществ, различающихся интенсивностью взаимодействия между молекулами (полярностью), уменьшения величины G(s)можно достичь за счет уменьшения s. Действительно, компонент менее полярный будет переходить из объема в поверхностный слой, поскольку накопление менее полярного компонента приведет к уменьшению межмолекулярного взаимодействия на поверхности раздела фаз, а, следовательно, к уменьшению удельной поверхностной энергии (s) и свободной поверхностной энергии G(s). Таким образом в поверхностном слое происходит концентрирование менее полярного компонента, называемое адсорбцией.Так как процесс адсорбции приводит к уменьшению свободной поверхностной энергии, он является самопроизвольным. Тепловое движение молекул стремится восстановить равенство концентраций в объеме и поверхностном слое. Равновесие устанавливается тогда, когда процесс адсорбции, приводящий к увеличению концентрации в поверхностном слое, компенсируется процессом диффузии из поверхностного слоя вглубь раствора (десорбция) . Это состояние равновесия, отвечающее минимуму свободной энергии всей системы,описывается уравнением адсорбции Гиббса, являющимся следствием второго начала термодинамики:
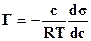 (6.2)
(6.2)
где Г – превышение концентрации адсорбированного вещества в поверхностном слое по сравнению с его концентрацией в объеме раствора; с – равновесная концентрация, 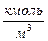 ; s - удельная поверхностная энергия,
; s - удельная поверхностная энергия, 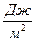 ; Т – температура, К; R – универсальная газовая постоянная,
; Т – температура, К; R – универсальная газовая постоянная,
R = 8,31×103 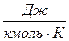 . Подставляя размерность всех величин в формулу (6.2), получим размерность величины адсорбции:
. Подставляя размерность всех величин в формулу (6.2), получим размерность величины адсорбции: 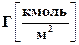 .
.
Величина 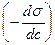 называется поверхностной активностью. Вещества, понижающие при растворении величину s на границе раздела фаз, т.е. способные адсорбироваться, называются поверхностно-активными веществами (ПАВ). В водных растворах поверхностно-активными являются растворимые в воде органические вещества (спирты, кислоты, амины и т.п.), молекулы которых дифильны. Дифильные молекулы ПАВ обычно обозначаются:
называется поверхностной активностью. Вещества, понижающие при растворении величину s на границе раздела фаз, т.е. способные адсорбироваться, называются поверхностно-активными веществами (ПАВ). В водных растворах поверхностно-активными являются растворимые в воде органические вещества (спирты, кислоты, амины и т.п.), молекулы которых дифильны. Дифильные молекулы ПАВ обычно обозначаются:

 ,
,
где кружок обозначает полярную группу, а черточка – неполярный радикал. С ростом длины углеводородной цепи неполярного радикала поверхностная активность увеличивается (правило Дюкло – Траубе).
Величина удельной поверхностной энергии (s) численно равна поверхностному натяжению на границе жидкость – газ. Это связано с тем, что поверхностное натяжение определяется силами взаимодействия между молекулами в поверхностном слое. Т.е. и удельная поверхностная энергия и поверхностное натяжение определяются работой, произведенной против сил межмолекулярного взаимодействия. Поэтому жидкости с более интенсивным полем молекулярных сил, т.е. более полярные, характеризуются высокими значениями s (например, вода: s = 72,75 ×10-3 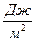 ; а гексан: s = 18,43×10-3
; а гексан: s = 18,43×10-3 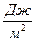 ).
).
Дата добавления: 2015-09-28; просмотров: 1478;
