Рубцовые стриктуры пищевода
Рубцовые стриктуры (сужения) пищевода (РСП) являются осложнением острых и хронических воспалительных процессов пищевода различной природы. Наиболее часто они развиваются в исходе коррозивного эзофагита, обусловленного химическим ожогом, и рефлюкс‑эзофагита, вызванного забросом агрессивного желудочного и/или кишечного содержимого на фоне несостоятельности пищеводно‑желудочного замыкательного механизма. Нередко наблюдаются и послеоперационные стриктуры пищевода, а точнее – пищеводных анастомозов.
Эзофагиты другой этиологии как причина РСП встречаются значительно реже (при туберкулезе, сифилисе, дифтерии, системных заболеваниях соединительной ткани – чаще склеродермии, радиационном поражении и др.).
Этиология и патогенез
Послеожоговые РСП являются осложнением химических ожогов пищевода. Последние возникают в результате случайного или преднамеренного (например, с целью самоубийства) приема едких веществ (кислот, щелочей и других химически агрессивных субстанций), обычно в жидком виде. В прошлом нередко встречались ожоги пищевода каустической содой, уксусной эссенцией, серной кислотой. В настоящее время чаще наблюдаются ожоги чистящими жидкостями, раствором аммиака, электролитом для заправки аккумуляторных батарей. Ожоги щелочами протекают в целом более тяжело, так как при этом формируется глубокий колликвационный (влажный) некроз, поражающий не только всю толщу пищеводной стенки, но и нередко распространяющийся на окружающую клетчатку и соседние органы. При ожогах кислотами образуется коагуляционный (сухой) некроз в виде плотного струпа, который в какой‑то мере ограничивает дальнейшее проникновение кислоты в более глубоко лежащие ткани.
В течении ожоговой болезни выделяют IV периода. Первые 3 периода продолжаются по 2 недели, IV период от 2 недель до 2 лет:
I период – гиперемия, отек, некроз;
II период – формирование ожогового струпа;
III период – отторжение ожогового струпа;
IV период – формирование рубцовой стриктуры.
Различают три степени тяжести химического ожога пищевода.
I степень характеризуется поражением поверхностных слоев эпителия слизистой пищевода. Вследствие ожога развивается десквамативный эзофагит, в исходе которого, как правило, происходит полное выздоровление. При II степени ожога слизистая поражается на всю глубину с частичным вовлечением подслизистого слоя. Развивается язвенно‑некротический эзофагит, а впоследствии – послеожоговая РСП. При III степени наблюдается поражение всех слоев стенки пищевода, нередко некроз распространяется на параэзофагеальную клетчатку, трахею, плевру, перикард и другие органы. Иногда наступает перфорация пищевода как следствие деструкции стенки органа. Тяжесть ожога зависит от характера, концентрации и количества выпитой агрессивной жидкости.
В клинической картине ожога пищевода преобладают сильные жгучие боли в полости рта, за грудиной и в эпигастрии, осиплость голоса, одышка, сильное слюнотечение. Вскоре после приема агрессивной жидкости развивается тяжелая дисфагия; попытка проглатывания жидкости резко болезненна. Часто бывает многократная болезненная рвота. Развивается картина интоксикации, вызванная резорбтивным действием яда. Нарастают гипертермия, олигоанурия. Ряд больных погибает именно от нарастания полиорганной недостаточности в первые часы после ожоговой травмы. Перфорация пищевода (или желудка) при III степени ожога резко ухудшает прогноз.
Если осложнения не развились, состояние больных к концу первой недели после ожоговой травмы заметно улучшается. Уменьшается интенсивность болей, саливация и жажда, улучшаются самочувствие и сон. Больные начинают глотать жидкую и густую пищу. Лишь с шестой‑седьмой недели дисфагия возникает вновь, свидетельствуя о формировании РСП.
Задача инструментальных методов диагностики в первые дни после ожога пищевода состоит в том, чтобы исключить развитие жизнеопасных осложнений. Рентгеноскопия пищевода осуществляется, как правило, с водорастворимым контрастом и служит для диагностики перфорации пищевода и пищеводно‑респираторных свищей. Эндоскопическое исследование многие специалисты считают противопоказанным (значительный риск перфорации!), хотя в ряде клиник оно используется для диагностики III степени ожога пищевода и особенно желудка, когда ранняя операция может предупредить развитие перфоративного медиастинита и/или перитонита. Обзорная рентгенография и ультразвуковое сканирование грудной клетки помогают установить диагноз плеврита и перикардита.
Первая помощь при химическом ожоге пищевода направлена на уменьшение агрессивных свойств токсического вещества. До прибытия «скорой помощи» больной должен прополоскать рот большим количеством воды, затем выпить воды и вызвать рвоту, повторяя эти действия несколько раз. Врачебная помощь заключается во введении анальгетиков (при возможности наркотических), седативных средств и промывании желудка через тонкий резиновый зонд, введенный через нос. Пациенты с химической травмой пищевода нуждаются в госпитализации, оптимально – в токсикологическое или реанимационное отделение. Там им проводят комплексное консервативное лечение (форсированный диурез, при необходимости – аппаратные методики детоксикации, антибактериальную терапию, введение кортикостероидов и т. д). По мере выведения больного из тяжелого состояния и формирования РСП к лечению подключается хирург.
Чтобы предупредить развитие РСП и уменьшить выраженность рубцового процесса, возможно применение раннего (профилактического) бужирования пищевода, начиная с 5 по 10 сутки после ожога. Определенный эффект оказывают протеолитические ферменты (лидаза), кортикостероиды и гипербарическая оксигенация.
Пептические стриктуры пищевода являются осложнением рефлюкс‑эзофагита. В свою очередь, рефлюкс‑эзофагит вызывается различными нарушениями замыкательного аппарата пищеводнокардиальной области, среди которых наиболее часто встречаются грыжи пищеводного отверстия диафрагмы (ГПОД). У ряда больных рефлюкс‑эзофагит развивается после операций на пищеводе и желудке (гастрэктомии, проксимальной резекции желудка, резекции пищевода, эзофагокардиомиотомии и др.). При длительном течении эзофагита воспалительный процесс распространяется на мышечный слой и даже на параэзофагеальную клетчатку с формированием РСП. Кроме того, стриктура может развиться при заживлении пептической язвы пищевода.
Обычно образование пептической РСП – процесс довольно длительный (в сравнении с послеожоговым сужением), растянутый на месяцы и годы. Однако в ряде случаев он развивается стремительно, например, при длительном стояния назогастрального зонда, обычно у больных, перенесших операции на органах брюшной полости с тяжелым, осложненным течением послеоперационного периода.
Послеоперационные рубцовые стриктуры чаще всего являются сужениями не самого пищевода, а анастомозов пищевода с желудком или кишкой, накладываемых при гастрэктомии, проксимальной резекции желудка или резекции пищевода. Причины их развития разнообразны: технические погрешности при формировании анастомоза (избыточная или недостаточная мобилизация сшиваемых органов, вовлечение в шов большого массива тканей, применение слишком толстых и грубых нитей и т. д.), вторичное заживление несостоятельности швов, значительная ишемия тканей в зоне соустья, индивидуальная реакция на шовный материал.
Нередко в клинической практике встречаются ситуации, когда в патогенезе РСП участвуют различные факторы. Так, в процессе формирования дистальной послеожоговой стриктуры пищевода вследствие вторичного укорочения пищевода развивается ГПОД. После проведенного бужирования просвет пищевода восстанавливается, но очень скоро стриктура рецидивирует, но уже не как ожоговая, а как пептическая, поскольку антирефлюксный механизм, ввиду повреждения дистального сегмента пищевода, резко нарушен.
Классификация
Классифицируют РСП по различным признакам (локализация и выраженность сужения, характер его, количество стриктур, наличие осложнений и др.).
Так, например, в классификации послеожоговых РСП Э. Н. Ванцяна и РА. Тощакова (1971) различают высокие стриктуры – глоточные, шейные, бифуркационные – и низкие – расположенные от эпифренальной части пищевода (т. е. нижнегрудного отдела) до кардии. По протяженности выделяют короткие (до 3 см) и трубчатые (более 3 см) стриктуры. Наконец, РСП бывают одиночными и множественными (двойной, тройной локализации и более).
Более подробную классификацию послеожоговых РСП предложили Г. Л. Ратнер и В. И. Белоконев (1982). Она является составной частью классификации так называемой послеожоговой непроходимости пищевода, которая бывает не только механической (обусловленной собственно стриктурой), но и функциональной (анорексия, функциональная дисфагия). Авторы классифицируют непроходимость пищевода по этиологии (ожоги кислотами, щелочами и другими агрессивными агентами); по времени развития (ранняя – до 4 недель, поздняя – позже 4 недель). Послеожоговые РСП разделяют так:
1. По степени сужения (соответственно выраженности дисфагии).
2. По локализации стриктуры:
а) высокие – устье пищевода, шейный отдел;
б) срединные – аортальные, бифуркационные;
в) низкие – эпифренальные, кардиальные;
г) комбинированные – пищевода и желудка.
3. По протяженности:
а) короткие: мембранозные, циркулярные (менее 3 см);
б) трубчатые (более 3 см);
в) четкообразные;
г) тотальные.
4. По форме супрастенотического расширения:
а) коническая;
б) мешотчатая.
5. По наличию осложнений:
а) ложные ходы в средостение;
б) дивертикулы пищевода;
в) рубцовое укорочение пищевода;
г) пищеводно‑респираторные свищи.
Классификация пептических стриктур пищевода, по сравнению с послеожоговыми, значительно проще. Так, А. Ф. Черноусов и соавт. (1999) считают принципиально важным деление пептических стриктур на короткие (до 3 см) и протяженные (более 3 см), а также на первичные (развиваются как осложнение рефлюкс‑эзофагита на почве ГПОД) и вторичные (являются осложнением безуспешных, часто повторных, хирургических вмешательств на кардии).
Рубцовые стриктуры пищеводных анастомозов классифицируются по виду анастомоза (пищеводно‑желудочный, пищеводнотолстокишечный, пищеводно‑тонкокишечный), уровню его расположения (высокие – шейного и верхнегрудного отделов пищевода, низкие – средне– и нижнегрудного отделов), протяженности (короткие – до 1 см, протяженные – более 1 см) и степени стеноза. Так, сотрудники отделения эндоскопической хирургии РНЦХ РАМН выделяют 4 степени сужения пищеводных анастомозов: I – диаметр соустья 9‑11 мм; II – 6–8 мм; III – 3–5 мм; IV – 0–2 мм (Ю.И. Галлингер, Э. А. Годжелло, 1999, Э. А. Годжелло, Ю.И. Галлингер, 2006). Такое деление определяет характер инструментария, который можно использовать для эндоскопического лечения стриктуры, и, кроме того, коррелирует со шкалой дисфагии (см. раздел «Рак пищевода»).
Клиническая картина и данные объективного исследования
В клинической картине РСП ведущим является симптомокомплекс нарушения проходимости пищевода, который составляют дисфагия, пищеводная рвота, потеря массы тела. Появление и прогрессирование этой симптоматики различаются при разных по происхождению типах РСП.
При послеожоговой рубцовой стриктуре через неделю после химической травмы глотание становится менее болезненным и более свободным, это связано с уменьшением отека. Постепенно болезненность проходит, дисфагия уменьшается. Однако с шестой недели по мере замещения грануляций фиброзной тканью вновь усиливается дисфагия, которая носит прогрессивно нарастающий характер. Приспосабливаясь к своему страданию, больные долго и тщательно пережевывают пищу, запивают ее жидкостью. Прием пищи существенно растягивается во времени. Затем, по мере ретракции рубцов, проходимость пищевода ухудшается. Возникает пищеводная рвота – сразу после проглатывания пищи. Далее пациент перестает глотать даже воду. Тяжелая обструкция пищевода, характеризующаяся III и IV степенями дисфагии, обычно сопровождается слюнотечением. Больные с трудом проглатывают слюну и вынуждены ее выплевывать, поэтому возникает ложное ощущение, что слюны стало выделяться существенно больше, чем раньше.
При длительном течении РСП пациенты довольно резко теряют в весе, вплоть до развития кахексии. При наличии выраженной дисфагии масса тела снижается весьма быстро.
Пептические стриктуры пищевода характеризуются несколько иной картиной. Длительное время у больных присутствуют жалобы, типичные для рефлюкс‑эзофагита: изжога, отрыжка кислым желудочным содержимым или воздухом, боли за грудиной. Изжога усиливается после еды и в наклонном положении туловища, а также при физической нагрузке. По мере формирования стриктуры появляется дисфагия, а изжога уменьшается и даже исчезает. Нередки боли за грудиной как при глотании, так и вне его, и боли в проекции мечевидного отростка грудины. Эрозии и язвы пищевода, сопутствующие пептической стриктуре, могут являться источником кровотечения, иногда довольно массивного.
В случаях развития послеоперационных РСП дисфагия появляется в сроки от 3–4 недель до 2–3 месяцев после хирургического вмешательства с наложением пищеводного анастомоза. Симптоматика таких стриктур напоминает таковую при сужениях пищевода другой природы, о которых упоминалось ранее.
Объективное исследование при РСП выявляет симптомы недостаточного питания: похудание, снижение тургора и эластичности кожи, истончение подкожного жирового слоя, атрофию скелетных мышц. Иногда при тяжелом сужении пищевода ощущается дурной запах изо рта вследствие застоя и гниения слизи и пищевых масс в супрастенотическом сегменте.
Лабораторная и инструментальная диагностика
В анализах крови наблюдаются неспецифические изменения. Могут быть выявлены анемия, электролитные нарушения. Объективным показателем расстройства водного баланса служит появление признаков «сгущения» крови: повышение содержания гемоглобина, гематокрита, эритроцитов и общего белка. В процессе проведения инфузионной терапии и парентерального питания эти показатели изменяются, приближаясь к «истинным» значениям, не замаскированным процессом тяжелой дегидратации. В ряде случаев – при выраженном эзофагите и аспирационных легочных осложнениях – имеет место лейкоцитоз.
Инструментальная диагностика РСП базируется на рентгенологическом и эндоскопическом исследованиях.
Для рентгеноскопии пищевода применяют жидкую взвесь сульфата бария. При выраженных его сужениях эффективно использование водорастворимого контраста (урографин, триомбраст, омнипак).
Послеожоговые стриктуры обычно циркулярные – трубчатые или кольцевидные, реже мембранозные, клапанные. Просвет органа в области стриктуры резко сужен вплоть до полной облитерации, при этом определяется супрастенотическое расширение в виде конуса или чаши (рис. 27).
Контуры сужения бывают довольно гладкими, рельеф слизистой отсутствует, перистальтика обычно не выявляется. При наличии множественных стриктур вышележащая диагностируется легко, но мешает обнаружению нижележащих.
Пептические РСП могут быть различной протяженности и почти всегда сочетаются с ГПОД. Короткая стриктура имеет вид симметричного сужения с ровными контурами длиной 1–2 см (рис. 28).
Протяженная пептическая стриктура цилиндрической формы, расположена в дистальной части пищевода. Длина ее может превышать 3–5 см. Стенки стриктуры ригидны, складки слизистой утолщены, извилисты. В ряде случаев в зоне сужения можно обнаружить язвенную нишу.
Эндоскопическое исследование в случае послеожоговой РСП выше стриктуры выявляет картину хронического эзофагита. В пищеводе при этом задерживаются слизь, слюна, остатки пищи. Могут быть видны рубцы в виде перемычек, гребней, клапанов.
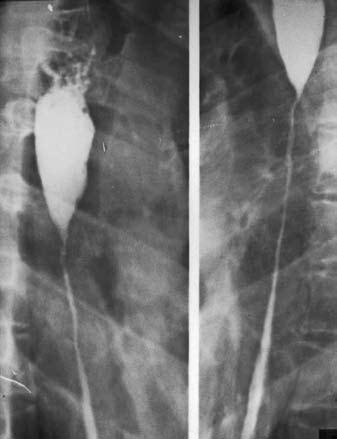
Рис. 27. Рентгенограмма пищевода при его послеожоговом рубцовом сужении . На снимке видны супрастенотическое расширение конической формы и протяженная стриктура средне– и нижнегрудного отделов пищевода.
Вход в стриктуру может располагаться как по центру, так и эксцентрично. Важной задачей эндоскопии является диагностика ожогового поражения глотки, что серьезно влияет на планирование объема операции. Участки рубцовых изменений могут чередоваться с непораженными, что бывает при двойных и множественных стриктурах. У больных с наложенной гастростомой для полноценного исследования пищевода применяют, помимо обычной, ретроградную эзофагоскопию. При пептических РСП пищевод выше стриктуры обычно расширен, содержит пену, слизь, остатки пищи. Слизистая в области сужения частично или полностью разрушена. Стенки пищевода ригидны, на сохранившейся слизистой – изъязвления, покрытые некротическими тканями и пленками фибрина. Слизистая часто рыхлая и при малейшем контакте с эндоскопом кровоточит, хотя может выглядеть и малоизмененной.
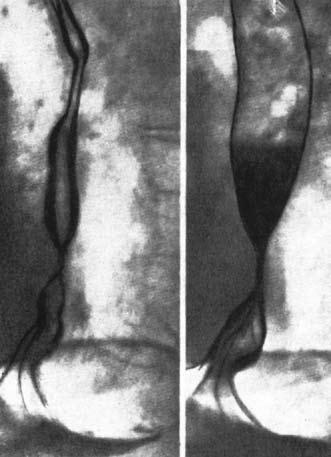
Рис. 28. Рентгенограмма пищевода при короткой пептической стриктуре на почве ГПОД. Пищевод укорочен, часть кардиального отдела желудка находится в заднем средостении. (Приводится по: Е.М. Каган. Рентгенодиагностика заболеваний пищевода. М., 1968)
Пищеводные анастомозы чаще бывают сужены циркулярно. Реже соустье имеет неправильную форму за счет большего вовлечения в процесс одной из стенок. Супрастенотическое расширение обычно не выражено. Явления застойного эзофагита выявляются только при значительных сужениях. Как правило, стриктуры пищеводных соустий короткие (5‑10 мм), реже – протяженные. Дифференциальная диагностика
Ввиду наличия характерного анамнеза диагностика послеожоговых РСП, как правило, не вызывает затруднений. Гораздо труднее выявить раковую опухоль на фоне послеожоговых рубцов. Обычно это происходит через 10–15 и более лет после химического ожога. Клинические проявления рака пищевода возникают на фоне его послеожоговой стриктуры, что нередко приводит к запоздалой диагностике рака.
Пептическую стриктуру пищевода иногда следует дифференцировать с эндофитной циркулярной раковой опухолью. При доброкачественной РСП эндоскопически в месте сужения пищевода определяется гладкая слизистая с фиброзной тканью. Иногда нелегко отличить от опухоли и тяжелые эрозивно‑язвенные изменения слизистой пищевода на фоне стриктуры, когда очаги изъязвления соседствуют с участками регенерации и пленками фибрина. Складки слизистой при этом либо отсутствуют, резко обрываясь на уровне стриктуры, либо изъедены и деформированы, что макроскопически соответствует «раковому рельефу». С целью дифференциальной диагностики рака пищевода и РСП применяют эндоскопию с биопсией, рентгеновское исследование, КТ, МРТ, эндосонографию пищевода.
При рубцовых сужениях пищеводных анастомозов нужно проводить дифференциальный диагноз с пептической стриктурой (при низкой локализации внутригрудного соустья) и рецидивом рака в зоне анастомоза. При рецидиве рака на одной из стенок пищевода (анастомоза) видны белесоватые разрастания, отличающиеся по виду от слизистой пищевода и полосок рубцовой ткани. Грануляции представляются ярко‑красными разрастаниями, легко кровоточащими при контакте с эндоскопом и занимающими всю окружность анастомоза, тогда как рецидивная опухоль поражает обычно одну из его стенок. В таких случаях необходимо выполнять биопсию из нескольких участков окружности анастомоза.
Лечение
Основным методом лечения различных РСП является бужирование, то есть расширение стриктуры с помощью специальных инструментов – бужей. При этом происходит растяжение и частичное разрушение грануляций и соединительной ткани в области стриктуры, что ведет к восстановлению просвета пищевода и, следовательно, полноценного перорального питания. При невозможности проведения бужирования или при его неэффективности прибегают к эзофагопластике (ЭП). Важными элементами лечения пептических РСП являются антирефлюксные операции и медикаментозная терапия.
Бужирование пищевода. Существует несколько способов бужирования. В прошлом широко применялось бужирование «вслепую», через рот. Однако этот метод сопровождался высокой частотой такого опасного осложнения, как перфорация пищевода. Поэтому сейчас «слепое» бужирование практически не используют. На смену ему пришли более надежные методы, позволяющие контролировать прохождение бужа через стриктуру.

Рис. 29 Бужи Savary‑Gilliard с внутренним каналом для насаживания бужа на струну‑направитель. (Приводится по: Э.А. Годжелло, Ю.И. Галлингер. Эндоскопическое лечение стриктур пищеводных анастомозов. М., 2006)
Возможно введение бужа под прямым контролем эндоскопа. Такой способ эффективен и безопасен для расширения коротких стриктур (например, стриктур пищеводных анастомозов). Для бужирования протяженных РСП он менее надежен, поскольку контролировать ход бужа через продленное сужение эндоскопическим путем почти невозможно. В современных условиях применяют бужирование по направляющей струне специальными бужами, имеющими канал для проведения струны – типа Savary‑Gilliard и им подобными (рис. 29).
Вначале металлическую струну с атравматическим пружинным наконечником проводят за область сужения под контролем эндоскопа. Затем нанизывают буж на струну‑направитель и осторожно продвигают буж через стриктуру (рис. 30).

Рис. 30. Бужирование РСП по струне‑направителю. Через стриктуру проводятся: А – струна (под контролем эндоскопа); Б – кончик бужа; В – средняя часть бужа. (Приводится по: Т. Rice «Dilation of Peptic Esophageal Strictures», Operative Techniques in Cardiac & Thoracic Surgery, Vol. 2, No. 1 (February), 199: pp 100–116)
После небольшой экспозиции буж извлекают и проводят бужирование расширителем большего размера. 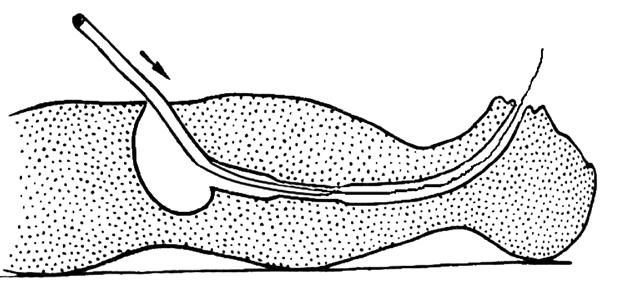
Рис. 31. Ретроградное форсированное бужирование пищевода. Кончик бужа пришит к направляющей нити. Тягой за нить осуществляют интраоперационное проведение бужа через гастротомическое отверстие… (Приводится с изменениями по: Г.Л. Ратнер, В. И. Белоконева. Ожоги пищевода и их последствия. М., 1982)
На следующий день выполняют контрольную рентгеноскопию пищевода для уточнения эффективности бужирования и исключения перфорации. Через 2–3 дня можно приступить к повторному бужированию. Наконец, при множественных и протяженных стриктурах применяют метод бужирования за направляющую нить. Первое бужирование требует выполнения небольшой лапаротомии. Выполняется гастротомия, из желудка извлекают направляющую струну и заменяют ее прочной нитью (капрон № 4–5). Этой нитью прошивают кончик бужа. Затем производят ретроградное бужирование (рис. 31) и после необходимой экспозиции буж извлекают. Нить выводят наружу через желудок и переднюю брюшную стенку, желудочную стенку фиксируют к париетальной брюшине вокруг нити по типу гастростомы по Кадеру.
По окончании процедуры верхний конец нити выводят через нос. Тем самым сохраняется возможность для выполнения повторных бужирований (после выведения нити через рот и фиксации к ней бужа последний проводят ортоградно).
Многие технические детали бужирования могут существенно различаться у разных исполнителей и в разных клиниках. Так, обезболивание может быть местным (орошение глотки спреем лидокаина) или общим (внутривенный или эндотрахеальный наркоз). Экспозиция бужа варьирует от нескольких минут до часа и более. Используются разные схемы поддерживающего бужирования и т. д. Но в большинстве случаев лечение послеожоговых РСП довольно длительное и занимает от 6 месяцев до нескольких лет. Эндоскопическое наблюдение следует проводить пожизненно – ввиду опасности возникновения раковой опухоли на фоне стриктуры.
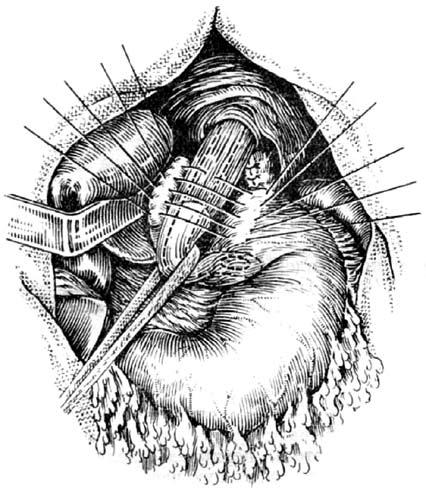
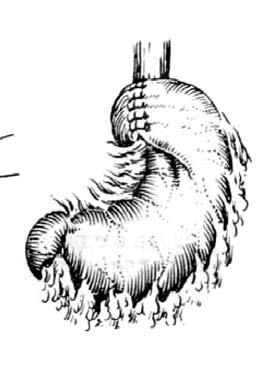
Рис. 32. Фундопликация по Ниссену. (Приводится по: А. А. Шалимов и соавт. Хирургия пищевода. М., 1975)
В последние годы в качестве альтернативы бужированию применяют баллонную дилатацию РСП. Результаты лечения примерно соответствуют таковым при бужировании, однако стоимость его значительно выше ввиду необходимости использования дорогостоящего расходного оборудования. Это обстоятельство существенно ограничивает широкое внедрение в практику данного метода лечения РСП. Антирефлюксные операции. Применяются для лечения пептических стриктур пищевода. Как правило, используются различные виды фундопликации и эзофагофундорафии. В нашей стране наиболее распространена фундопликация типа Ниссена. При этом формируют манжетку из стенок желудка, сшиваемых вокруг пищевода. Образующийся в области кардии клапан функционирует как антирефлюксный барьер (рис. 32).
За рубежом популярны, кроме того, операции Белеи, Хилла, Коллиса, Дора, Тупе. Эти вмешательства устраняют ГПОД, препятствуют желудочно‑пищеводному рефлюксу и в ряде случаев позволяют избежать развития осложнений, характерных для фундопликации по Ниссену (избыточная функция фундопликационной манжеты, с чем связаны затруднение или невозможность срыгивания и рвоты). При этих операциях выполняется парциальная фундопликация, заключающаяся не в полном окутывании пищевода стенками желудка, а в частичной фиксации дна желудка кпереди от пищевода (операция Дора) или кзади от него (операция Тупе). Основные этапы операции Белеи – мобилизация пищевода трансторакальным доступом, формирование фундопликационной манжеты на 240♦ и фиксация ее специальными швами к абдоминальной поверхности диафрагмы с дальнейшим ушиванием пищеводного отверстия диафрагмы до нормальных размеров.
Идея операции Коллиса заключается в удлинении абдоминальной части пищевода за счет создания желудочной трубки из правой половины желудка (т. е. части его, прилегающей к малой кривизне). При этом часть желудка низводится из грудной полости в брюшную, воссоздается острый угол Гиса (рис. 33). В современной практике эта операция применяется при сочетании рефлюкс‑эзофагита или пептической стриктуры с вторичным укорочением пищевода и, как правило, сочетается с каким‑либо вариантом фундопликации (операции Коллиса‑Ниссена и Коллиса‑Белси).
Тем самым купируется эзофагит и восстанавливается проходимость пищевода.
При необходимости после антирефлюксных операций делают поддерживающее бужирование. Обязательным элементом терапии рефлюкс‑эзофагита является медикаментозное лечение (антациды, антисекреторные средства – обычно Н2‑блокаторы гистаминорецепторов и блокаторы протонной помпы, прокинетики, антихелико‑бактерные препараты и др.).
Резекция пищевода с одномоментной эзофагопластикой (ЭП) и шунтирующая ЭП. При неэффективности или невозможности бужирования, неудаче антирефлюксных операций показана резекция пищевода. Пораженный пищевод необходимо (при наличии технических возможностей и если позволяет состояние больного) удалить. Это позволяет радикально устранить риск озлокачествления в области стриктуры и использовать заднее средостение для проведения желудочного или кишечного трансплантата. Функциональные результаты заднемедиастинальных ЭП существенно лучше, чем загрудинных и тем более антестернальных. Оптимальным объемом операции является субтотальная резекция или экстирпация пищевода. У пациентов с высоким хирургическим риском допустимо не удалять собственный пищевод, а выполнять шунтирующую ЭП желудочным или кишечным трансплантатом. Главный недостаток резекционной операции – высокая травматичность.
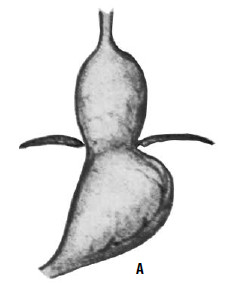
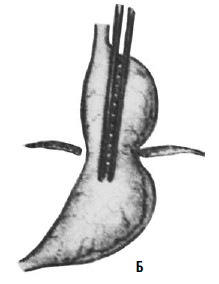
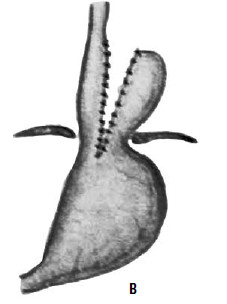
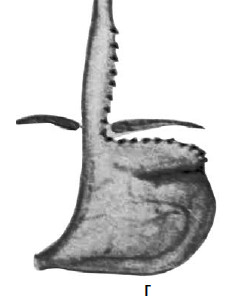
Рис. 33. Схема операции Коллиса: А – положение желудка до операции; Б – на желудок наложены жомы; В – рассеченные стенки желудка сшиты; Г – вновь созданное дно желудка низведено в брюшную полость. (Приводится по: Б. В. Петровский и соавт. Хирургия диафрагм. М., 1965)
Однако во многих специализированных клиниках процент осложнений и летальных исходов после ЭП сведен к минимуму. Так, послеоперационная летальность у больных неопухолевыми заболеваниями пищевода на современном этапе не превышает 3–5%. Функциональные исходы ЭП, как правило, хорошие. Пациенты после успешной операции избавляются от необходимости частых госпитализаций, курсов бужирования и перестают быть «привязанными» к клинике, поскольку бужирования до этого им выполняли многократно.
Дата добавления: 2015-09-18; просмотров: 1161;
