H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH
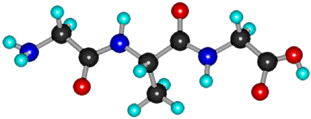
глицилаланилглицин
Рисунок 16
Аналогично происходит образование тетра-, пента- и полипептидов.
· Количество изомерных пептидов резко возрастает с увеличением числа участвующих в их образовании неодинаковых α-аминокислот. В живом организме (in vivo) биосинтез полипептидов (белков) с заданной природой последовательностью α-аминокислотных остатков направляют дезоксирибонуклеиновые кислоты (ДНК). Непосредственно его осуществляют рибонуклеиновые кислоты (РНК информационные, транспортные, рибосомные) и ферменты.
· Для искусственного получения олиго- и полипептидов заданного строения применяются специальные приёмы пептидного синтеза: блокирование (защита) одних функциональных групп и активация других.
· При синтезе полипептидов, содержащих большое число аминокислотных остатков, требуется проведение множества реакций, которые сопровождаются операциями по выделению и очистке продукта на каждой стадии. В классическом синтезе это сопряжено не только с большими затратами времени, но и с потерями вещества, поэтому при завершении эксперимента удается получить лишь ничтожно малые количества конечного продукта.
· Для решения этих проблем был предложен твердофазный синтез пептидов на полимерной матрице (Мэррифилд, 1962). В настоящее время созданы автоматизированные приборы (синтезаторы), которые в запрограммированной последовательности осуществляют все необходимые операции. Если в классическом синтезе для присоединения одной аминокислоты требуются дни и даже недели, то условия твердофазного синтеза позволяют присоединить 6 аминокислот в сутки.
Молекулярные массы различных белков (полипептидов) составляют от 10000 до нескольких миллионов. Макромолекулы белков имеют стеререгулярное строение, исключительно важное для проявления ими определенных биологических свойств. Несмотря на многочисленность белков, в их состав входят остатки не более 22 α-аминокислот.
Функции белков в природе универсальны:
- каталитические (ферменты);
- регуляторные (гормоны);
- структурные (кератин шерсти, фиброин шелка, коллаген);
- двигательные (актин, миозин);
- транспортные (гемоглобин);
- запасные (казеин, яичный альбумин);
- защитные (иммуноглобулины) и т.д.
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
Выделяют 4 уровня структурной организации белков.
| Первичная структура - определенная последовательность α-аминокислотных остатков в полипептидной цепи. | 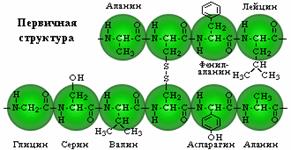
| ||||
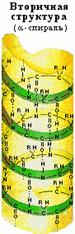
| Вторичная структура - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. Одна из моделей вторичной структуры - α-спираль. Другая модель - β-форма ("складчатый лист"), в которой преобладают межцепные (межмолекулярные) Н-связи. | ||||
| Третичная структура - форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий. | 
| ||||

| Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей | ||||
Рисунок 17
Дата добавления: 2015-09-02; просмотров: 1057;
