ПРЕВРАЩЕНИЯ БЕЛКОВ В ТЕХНОЛОГИЧЕСКОМ ПОТОКЕ
Нативная трехмерная структура белков поддерживается разнообразием внутри- и межмолекулярных сил и поперечных связей. Любое изменение условий среды в технологических потоках производства пищевых продуктов оказывает влияние на нековалентные связи молекулярной структуры и приводит к разрушению четвертичной, вторичной и третичной структуры. Разрушение нативной структуры, сопровождающееся потерей биологической активности (ферментативной, гормональной), называют денатурацией. С физической точки зрения денатурацию рассматривают как разупорядочение конформации полипептидной цепи без изменения первичной структуры. Процесс денатурации протомера схематически представлен на рис. 2.17. Денатурация олигомерного белка заключается в диссоциации на протомеры, сопровождающейся или не сопровождающейся изменением их конформации.
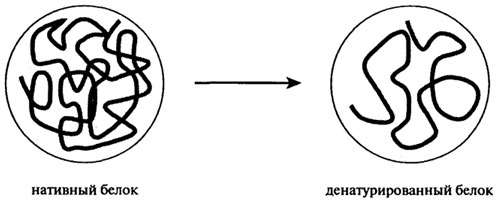
Рис. 2.17. Схема денатурации протомера
Большинство белков денатурируются в присутствии сильных минеральных кислот или оснований, при нагревании, охлаждении, обработке поверхностно-активными веществами (додецилсульфатом), мочевиной, гуанидином, тяжелыми металлами (Ag, Pb, Hg) или органическими растворителями
(этанолом, метанолом, ацетоном). Широкое применение кислот, оснований, солей, органических растворителей предусматривается в практике выделения белков из пищевого сырья и готовых продуктов при изучении их свойств и структурных особенностей, а также при экстракции и очистке в технологии выделения концентратов и изолятов. Денатурированные белки обычно менее растворимы в воде, так как их полипептидные цепи настолько сильно переплетены между собой, что затрудняется доступ молекул растворителя к радикалам остатков аминокислот.
Большая часть белков денатурируется при 60–80°С, однако встречаются белки и термостабильные, например, α-лактоглобулин молока и α-амилазы некоторых бактерий. Повышенная устойчивость белков к нагреванию часто обуславливается наличием в их составе большого количества дисульфидных связей. Однако степень денатурирующего воздействия температуры на белки зависит и от их влажности, реакции и солевого состава среды и присутствия небелковых соединений. Например, температура денатурации белков сои и подсолнечника существенно понижается в присутствии кислот жирного ряда, в кислой и влажной среде, но повышается в присутствии сахарозы и крахмала.
Факторы, вызывающие денатурацию белков, имеют особо важное значение для регулирования активности ферментов. Любые воздействия, направленные на стабилизацию вторичной и третичной структуры, приводят к повышению активности ферментов, а те, которые разрушают нативную структуру, – к их инактивации.
При температуре от 40–60°С до 100°С со значительной скоростью протекает взаимодействие белков с восстанавливающими сахарами, сопровождающееся образованием карбонильных соединений и темноокрашенных продуктов – меланоидинов (реакция Майяра). Сущность реакций меланоидинообразования заключается во взаимодействии группы –NH2 аминокислот с гликозидными гидроксилами сахаров (см. гл. 3). Сахаро-аминные реакции являются причиной не только потемнения пищевых продуктов, но и уменьшения в них сухого вещества и потерь незаменимых аминокислот (лизина, треонина). Меланоидины понижают биологическую ценность изделий, так как снижается усвояемость аминокислот из-за того, что сахароаминные комплексы не подвергаются гидролизу ферментами пищеварительного тракта. К тому же количество незаменимых аминокислот уменьшается. Это уменьшение происходит не только за счет взаимодействия их с восстанавливающими сахарами, но и за счет взаимодействия между собой функциональных групп –NH2 и –СООН самого белка. Реакции протекают с образованием внутренних ангидридов, циклических амидов и ω–ε изопептидных связей. Механизм образования связей с участием глутаминовой кислоты и ее амида представлен на рис. 2.18. Изопептиды обнаружены в кератине, молочных белках и белках мяса.
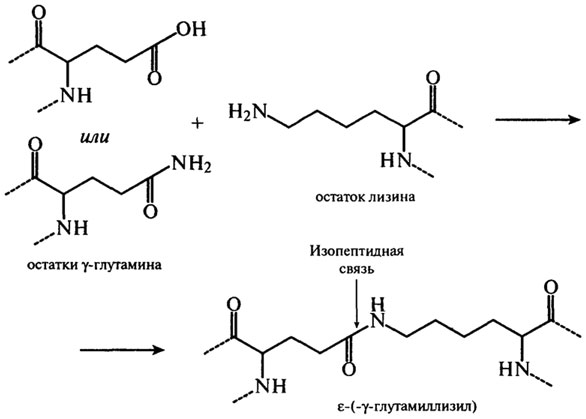
Рис. 2.18.Механизм образования изопептидных связей
Тепловая денатурация белков является одним из основных физико-химических процессов, лежащих в основе выпечки хлеба, печенья, бисквитов, пирожных, сухарей, сушки макаронных изделий, получения экструдатов и сухих завтраков, варки, жарения овощей, рыбы, мяса, консервирования, пастеризации и стерилизации молока. Данный вид превращений относится к полезным, так как он ускоряет переваривание белков в желудочно-кишечном тракте человека (облегчая доступ к ним протеолитических ферментов) и обуславливает потребительские свойства пищевых продуктов (текстуру, внешний вид, органолептические свойства). В связи с тем, что степень денатурации белков может быть различной (от незначительной до полного изменения расположения пептидных цепей с образованием новых ковалентных –S–S-связей), то и усвояемость полимеров может не только улучшаться, но и ухудшаться. Параллельно могут изменяться физико-химические свойства белков. Для хлопковых семян, подвергнутых влаготепловой обработке, зафиксирован, например, переход растворимого азота из одной формы в другую:
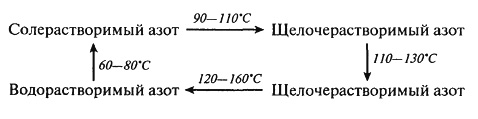
Термическая обработка белоксодержащей пищи при 100– 120°С приводит не к денатурации, а к разрушению (деструкции) макромолекул белка с отщеплением функциональных групп, расщеплением пептидных связей и образованием сероводорода, аммиака, углекислого газа и ряда более сложных соединений небелковой природы. Так, стерилизация молочных, мясных и рыбных продуктов при температуре выше 115°С вызывает разрушение цистеиновых остатков с отщеплением сероводорода, диметилсульфида и цистеиновой кислоты:
| H2S | CH3-S-CH3 | HO2C-CH(NH2)CH2SO3H |
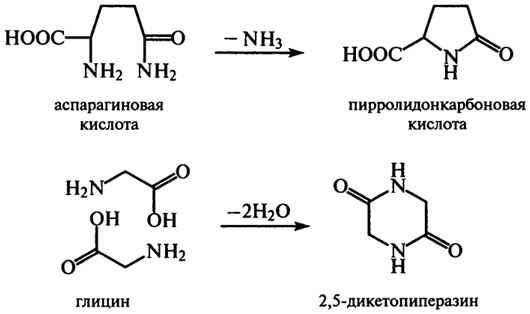
Реакции дезамидирования аспарагиновой и глутаминовой аминокислот и дегидратации глицина могут быть причиной образования новых ковалентных связей в белках, так как образуется пирролидонкарбоновая кислота и 2,5-дикетопиперазин (дикетопиперазина много в обжаренных бобах какао):
Среди продуктов термического распада белков встречаются соединения, придающие им мутагенные свойства. Термически индуцированные мутагены образуются в белоксодержащей пище в процессе ее обжаривания в масле, выпечки, копчения в дыму и сушки. Мутагены содержатся в бульонах, жареной говядине, свинине, домашней птице, жареных яйцах, копченой и вяленой рыбе. Некоторые из них вызывают наследственные изменения в ДНК, и их воздействие на здоровье человека может быть от незначительного до летального.
В экстрактах, выделенных из жареной рыбы и мяса, еще в 70-х гг. найдены продукты пирролиза аминокислот, образующиеся обычно при 500–600°С. Продукты идентифицированы как Трп–П–1 и Трп–П–2 из триптофана, Фен–П–1 из фенилаланина, Глу–П–1
и Глу–П–2 из глутаминовой кислоты, Лиз–П–1 из лизина, Орн–П–1 из орнитина:
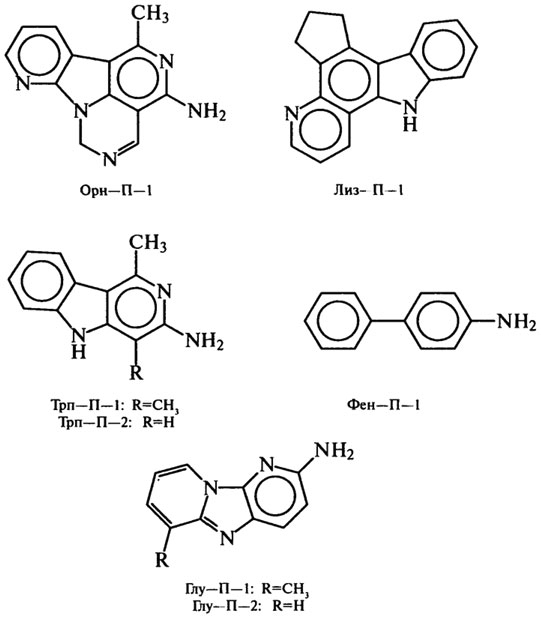
Другая группа мутагенных соединений в белковой пище открыта в 80-х гг. в умеренно нагретом мясе (ниже 200°С) и пищевых бульонах:
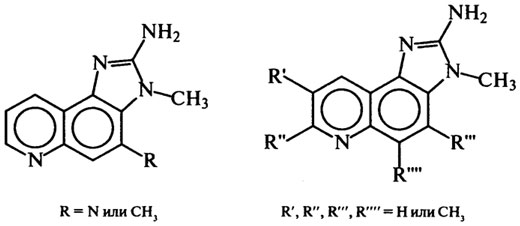
Токсические свойства белков при термической обработке выше 200°С или при более низких температурах, но в щелочной среде, могут обуславливаться не только процессами деструкции, но и реакциями изомеризации остатков аминокислот из L- в D-форму. Присутствие D-изомеров понижает усвояемость белков. Например, термообработка казеина молока при температуре около 200°С снижает биологическую ценность продукта на 50%.
В сильнощелочных средах, особенно при высоких температурах, некоторые остатки аминокислот претерпевают ряд специфических превращений. Так, аргинин превращается в орнитин, цитруллин, мочевину и аммиак, а цистеин – в дегидроаланин с выделением сероводорода:
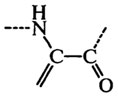
Реакционноспособный дегидроаланин конденсируется с остатками лизина, орнитина и цистеина боковых цепей и образует межмолекулярные поперечные связи в белках:
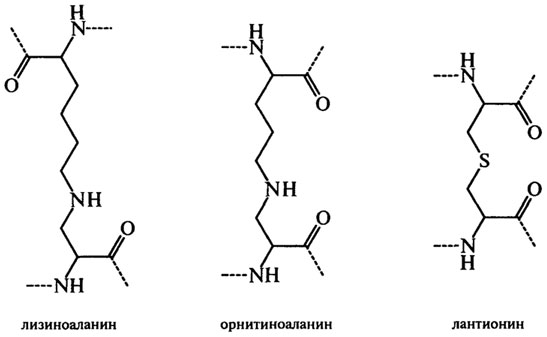
В реакцию конденсации могут вступать остатки аргинина, гистидина, треонина, серина, тирозина и триптофана. Питательная ценность белков с новыми поперечными связями ниже, чем у белков с нативной структурой, поэтому образование их в технологических процессах производства пищевых продуктов нежелательно. К тому же в опытах на крысах показано, что образование, например, лизиноаланина стимулирует нефрокальциноз, диарею и облысение.
Обработка сырья растворами щелочей широко используется при получении изолятов и концентратов белков. Чем ниже значение рН, температура и время обработки, тем выше содержание незаменимых аминокислот в белке. Например, при повышении рН раствора с 8,5 до 12,5 при экстракции белка из пшеничных отрубей количество лизина в нем уменьшается на 40%, треонина – на 26%, а валина – на 24%. Мягкие температурные режимы предохраняют от образования в больших количествах нежелательных аминокислотных фрагментов. В то же время среди специалистов обсуждается вопрос о введении предельно допустимых концентраций лизиноаланина (например, 300 мг на 1 кг) в целях обеспечения безопасности белоксодержащей пищи.
Неблагоприятные погодные условия при созревании зерна, поражение его вредителями и микрофлорой, пониженная или повышенная температура при хранении и переработке сырья и полуфабрикатов, механические, физические и химические факторы (перемешивание, гомогенизация, замес, инфракрасное облучение, ультразвук, действие солей, диоксида углерода, газообразных азота и этилена и т. д.) усиливают структурные перестройки белков, которые могут разрушать природные белково-липидные взаимодействия. Высвобождающиеся липиды, подвергаясь окислительной порче, способны инициировать образование ковалентных меж- и внутримолекулярных связей в белках и новых полимерах:
| R – H + LO˙22; → R˙ + L02H; | R˙ + R˙ → R-R; | |
| R – R + LO˙2 → R – R˙ + L02H; | R – R˙ + R˙ → R-R-R | и т. д. |
Остатки тирозина в присутствии гидропероксидов (LO2H) могут превращаться в сульфоксиды и сульфоны, остатки цистеина – в сульфиновые, сульфоновые кислоты, а остатки триптофана – в гидрокси-β-индолилаланин и N-формилкинуренин. Все реакции окисления связаны с потерей незаменимых аминокислот. Окислительная порча белков особенно опасна при переработке масличного и жирового сырья. Торможение реакций можно достигать добавлением оксидантов, ферментных препаратов или повышением активности собственных ферментов сырья в целях вывода липидов из взаимодействия с белками.
Использование новых и традиционных технологических процессов без глубокого изучения влияния их на молекулярные основы структуры белков, с одной стороны, опасно для здоровья людей, а с другой – неэффективно с точки зрения обеспечения качества пищевых продуктов. Примером может служить научно обоснованное применение аскорбиновой кислоты для улучшения качества хлеба.
По современным представлениям, аскорбиновая кислота, окисляясь кислородом воздуха в дегидроаскорбиновую кислоту, окисляет глютатион (Г-SH), превращая его в окисленную форму (Г-S-S-Г). Это предохраняет глютатион от участия в сульфгидрильно-дисульфидном взаимодействии с белками клейковины во время образования теста. Сульфгидрильные группы пшеничного белка взаимодействуют друг с другом с образованием дисульфидносвязанных белковых цепей и качество изделий улучшается.
Наряду с окислительными процессами в технологических процессах, предусматривающих механические или физические воздействия на белковые вещества сырья (замес, гомогенизация, ультразвук и т.д.), протекают и другие превращения, характер которых зависит от природы, степени и способа этих воздействий. На начальных стадиях замеса хлебного теста и при измельчении семян зерна наблюдается тепловая агрегация белков, при усиленной механической обработке теста возможна деструкция последних с разрывом дисульфидных и даже пептидных связей.
Агрегирующая и комплексообразующая способность белков пшеницы является одним из важных показателей, обеспечивающих им ведущую роль в формировании клейковины в процессе ее отмывания из муки и тестоведения. Параметры агрегации определяют по методу японских исследователей (Т. Arakawa, D. Yonezawa, 1975). Для этого смешивают растворы клейковинных белков в 0,01 н уксусной кислоте и 0,2 М натрий-фосфатного буферного раствора (рН 5,6), содержащего 2 М NaCl. Измеряют оптическую плотность раствора (λ = 350 нм) во времени агрегации процесса и рассчитывают коэффициент начального этапа агрегации (К) и показатель агрегации (t10/c), характеризующий степень помутнения раствора в течение 10 мин.
Константу начальной скорости агрегации рассчитывают по уравнениям:
К =
| r |
| c4 |
и τ3 = 3rt + τ03,
где τ – оптическая плотность раствора при λ = 350 нм; r – постоянная, отражающая изменение τ3 в первые 1–1,5 мин агрегации; t – время агрегации; τ0 – оптическая плотность при t = 0; с – концентрация белка, %.
Параметры агрегации белков сильных пшениц, характеризующиеся более "плотной" пространственной упаковкой структуры, выше по сравнению со слабыми, имеющими более "рыхлую" организацию молекул (рис. 2. 19). Процесс образования белковых агрегатов по ходу технологического процесса приготовления изделий из муки интенсивнее у крепкой клейковины, чем у слабой.
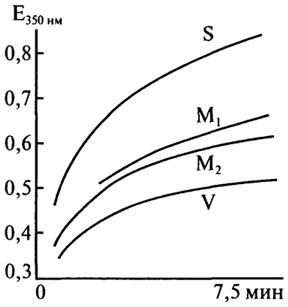
Рис. 2.19.Кривая помутнения раствора с клейковиной из муки разного качества (Т. Arakawa, D.Yonezawa, 1975): S – сильная мука; М( и М2 – средняя; W – слабая
Константы агрегации уксуснорастворимых белков, экстрагированных из предварительно отмытой клейковины и теста, выше, чем белков, выделенных из муки [В. Колпакова, Е. Молчанова, 1991]. Следовательно, при гидратации белков в ходе технологического процесса и, в частности, при замесе теста или отмывании клейковины водой происходят внутри- и(или) межмолекулярные превращения, связанные с изменением структуры молекул, приводящим к снижению агрегирующих свойств последних.
Наиболее высокие показатели агрегации наблюдаются у α- и γ-компонентов глиадина, наименее – у ω-компонентов. Способность к агрегации возрастает по мере увеличения подвижности полипептидов и уменьшения их молекулярной массы. Очень высокой способностью образовывать надмолекулярные ассоциаты обладают быстроподвижные α-глиадины с молекулярной массой 31 000.
Агрегирующая способность белков взаимосвязана с особенностями аминокислотного состава. Так, суммарный глиадин с более повышенной агрегирующей способностью содержит меньше заряженных групп, а ω-глиадины, обладающие низкой степенью агрегации, богаты пролином, фенилаланином, амидогруппами и полярными аминокислотными остатками. Это определяет высокую способность их к взаимодействию с другими компонентами муки и, прежде всего с липидами и липидоподобными соединениями (дигалактозилдиглицерид). Комплексообразование последнего с ω-глиадинами за счет водородных связей обуславливает газоудерживающую способность теста и объем хлеба. Имеются данные, что структура комплексов белки–липиды имеет сходство со структурой белок-липидных мембран.
В агрегации и взаимодействии молекул клейковинных частиц с другими компонентами муки в технологических процессах производства хлеба, макаронных изделий, печенья и т.д., наряду с водородными связями, принимают участие гидрофобные, ионно-электростатические и дисульфидные связи.
Способность белков к формированию высоко агрегированных и надмолекулярных образований зависит от рН, ионной силы и состава среды
(присутствие денатурирующих, солюбилизирующих, восстанавливающих и других агентов).
С повышением рН от 4,0 до 9,1 агрегация белков злаковых культур (пшеницы, ржи, ячменя) повышается. Чем больше концентрация нейтральных солей, тем агрегирующая способность белков выше. Отсюда, определенные дозировки поваренной соли способны регулировать образование или разрушение макромолекул клейковинного белка в состоянии пространственно организованной структуры пшеничного теста при производстве, например, хлеба.
Определенное влияние на агрегативное состояние запасных белков оказывают детергенты (ПАВ) различной природы: анионные, катионные, нейтральные. В присутствии анионного детергента в кислой среде, когда молекулы имеют положительный заряд, агрегация белка максимальна. Действие же катионных и нейтральных детергентов в направлении усиления или ослабления агрегации неоднозначно и зависит от рН среды и их концентрации.
В целом же, агрегирующая способность запасных белков различных зерновых культур в ходе технологического процесса может быть представлена в виде интегральной суммы множества взаимодействий, способствующих или препятствующих образованию надмолекулярных структур:
∑A = ∆Аи +∆Аг+∆Ав +∆Ан +∆Аα +∆Ад + ...,
где ∆Аи – агрегация белка за счет ионно-электростатических сил; ∆Аг – гидрофобных взаимодействий; ∆Ав – водородных связей; ∆Ан – набухания (гидратации); ∆Аα – изменения регулярных структур; ∆Ад – содержания дисульфидных связей.
Степень участия того или иного фактора в изменении агрегативного состояния белков, а с ним и реологических свойств теста и качества хлеба, зависит от исходных физико-химических свойств и структурных особенностей белков муки, технологических факторов процесса (температура, степень механического воздействия, рН среды и т. д.), химической природы и количества дополнительного сырья, улучшителеи и пищевых добавок.
Огромное значение для изменения свойств и агрегативного состояния белков в ходе технологического процесса приготовления теста имеет дисульфидно-сульфгидрильный обмен:
P1S-SP2 + P3SH → Р1S – SР3 + P2SH
Считают, что лабильность дисульфидных связей обеспечивает образование новых прочных межмолекулярных связей и релаксацию (ослабление) напряжения структур клейковины при замесе теста.
Сильная мука, содержащая крепкую клейковину, требует больше времени замеса, так как она содержит больше дисульфидных связей и меньше SH-групп, чем слабая.
В процессе созревания муки при ее отлежке, а также под влиянием окислителей типа броматов, улучшение реологических свойств клейковины объясняется увеличением содержания S-S-связей и уменьшением, соответственно, SH-групп. В присутствии восстанавливающих агентов (сульфит натрия) реологические свойства клейковины ухудшаются, как это имеет место в прорастающем зерне или в процессе приготовления теста из зерна, пораженного клопом-черепашкой. Во всех случаях показатели качества и реологические характеристики теста взаимосвязаны с изменением в соотношении S–S-связей и SH-групп в белках.
Процессы образования или распада S– S-связей в созревающем и прорастающем зерне пшеницы протекают при участии специфических ферментов тиол–дисульфидного обмена: тиол– кислородоксидоредуктаза (КФ 1.8.3.2) и тиол–протеиндисульфидредуктаза (КФ 1.8.4.2). Предполагают, что направленное регулирование активности указанных выше ферментов в процессе приготовления теста является действенным приемом улучшения технологических свойств муки в целях обеспечения надлежащего качества хлеба [Т. Горпинченко, 1995].
В результате действия протеолитических ферментов в технологическом потоке производства пищевых продуктов белковые вещества так же претерпевают ряд существенных изменений. Так, на стадии солодоращения при производстве пива в эндосперме ячменя наблюдается гидролиз глобулина (эдестин), альбумина (лейкозин), проламина (гордеин) и глютелина с накоплением азотистых соединений с более низкой молекулярной массой (пептиды, аминокислоты). В результате в зерне накапливается растворимая, коагулируемая и аминная формы азота, тогда как в зародышевом листке и ростках зерна, наоборот, увеличивается количество белкового азота за счет процессов синтеза.
Высокомолекулярные фракции белков при прорастании зерна расщепляются под действием ферментов эндопептидаз по схеме:
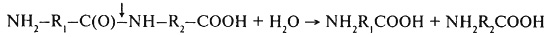
и экзопептидаз (дипептидаз и полипептидаз). Полипептидазы включают аминопептидазы (а-аминоацилпептидгидролазы, 3.4. 1 ), для действия которых необходимы свободные аминогруппы (– NH2), и карбоксипептидазы (пептидиламинокислотные гидролазы, 3.4.2), требующие для гидролиза свободные карбоксильные группы (– СООН).
Технологические режимы проращивания зерна предусматривают оптимальные условия (рН, температура) действия гидролитических ферментов
для обеспечения накопления низкомолекулярных азотистых соединений для питания дрожжей сусла.
В традиционной технологии производства хлеба и мучных кондитерских изделий из муки нормального качества при тестоведении не протекают глубокие реакции гидролиза белков, свидетельствующие об изменении их первичной структуры, тогда как слабые процессы пептизации низкомолекулярных азотистых соединений, являющихся продуктами незавершенного синтеза в зерне, могут иметь место. Изменения структуры белков в процессе тестоприготовления ограничиваются, как правило, дезагрегацией, агрегацией молекул и изменением высших уровней ее организаций (вторичная, третичная, четвертичная структуры).
101 :: 102 :: 103 :: 104 :: 105 :: 106 :: 107 :: 108 :: 109 :: 110 :: 111 :: 112 :: Содержание
112 :: 113 :: 114 :: 115 :: 116 :: 117 :: 118 :: 119 :: 120 :: 121 :: Содержание
Дата добавления: 2015-11-18; просмотров: 2029;
