Растворимость газов в жидкостях. Вода является полярным растворителем, а газы в большинстве своем мало полярны, поэтому растворимость газов в воде достаточно низка.
Вода является полярным растворителем, а газы в большинстве своем мало полярны, поэтому растворимость газов в воде достаточно низка.
С повышением температуры растворимость газов снижается, и повышается с ее понижением.
С повышением давления растворимость газов увеличивается.
Растворимость газов в жидкостях подчиняется закону Генри-Дальтона:
При постоянной температуре растворимость каждого из компонентов газовой смеси в данной жидкости прямо пропорциональна его парциальному давлению*** над жидкостью и не зависит от общего давления газовой смеси и содержания других компонентов.
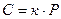
к – коэффициент пропорциональности, зависит от природы газа, растворителя и температуры( табличное значение );
р –парциальное давление газа над раствором;
С – концентрация растворенного газа.
***Парциальное давление – это та доля давления, которая приходится на каждый газ в отдельности
( р=N Р; где N- мольная доля , Р- общее давление газовой смеси )
Количественная зависимость между растворимостью газа и температурой выражается уравнением Клайперона-Клаузиуса
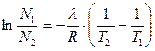 ,
,
где N1 и N2 – растворимость газа при Т1 и Т2
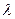 - мольная теплота растворения
- мольная теплота растворения
Т1 и Т2 – температура, 0К
R – универсальная газовая постоянная, R = 8,31Дж/к моль.
Закон Сеченова гласит, что присутствие в воде солей снижает растворимость газов:
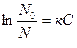
где N0 и N – растворимость газов в чистой воде и растворе;
С – концентрация, моль/л;
к – константа Сеченова.
Дата добавления: 2015-08-11; просмотров: 1212;
