Изомерия
Еще в 1814 г. французский ученый Гей-Люссак установил, что некоторые вещества при одном и том же качественном и количественном составе обладают различными физическими и химическими свойствами. Например, состав C2H6O и, соответственно, молекулярный вес 46,07 имеют два различных изомерных органических вещества: этиловый спирт – жидкость, кипящая при 78,4 оС, смешивающаяся с водой в любых соотношениях, и диметиловый эфир – газ, почти не растворимый в воде и существенно отличающийся от этилового спирта по химически свойствам.
Это явление, заключающееся в существовании нескольких химических соединений с одинаковым качественным и количественным составом, но отличных по физическим и химическим свойствам, было названо изомерией. Указанные соединения получили название изомеров.
Сущность явления изомерии была раскрыта в теории Бутлерова. Выяснилось, что изомерия обусловлена различным химическим строением, т.е. различием в порядке соединения атомов в молекулах при одном и том же составе и молекулярном весе веществ.
Для каждого из трех простейших углеводородов (метана, этана и пропана) возможно по одной структурной формуле:
H H H H H H
ï ï ï ï ï ï
H¾C¾H; H¾C¾C¾H; H¾C¾C¾C¾H.
ï ï ï ï ï ï
H H H H H H
В молекуле пропана четвертый углеродный атом может быть присоединен либо к одному из двух крайних углеродных атомов, либо к среднему. Цепь из четырех атомов углерода, как видим, дает начало двум изомерным молекулам состава C4H10 с различными углеродными скелетами:
H H H H H H H
ï ï ï ï ï ï ï
H¾C¾C¾C¾C¾H (1), H¾C¾¾C¾¾C¾H (2)
ï ï ï ï ï ï ï
H H H H H H¾C¾H H
ï
H
изображаемым сокращенно:
CH3—CH2—CH2—CH3 (1), CH3—CH—CH3 (2).
ï
CH3
Первый изомер углеводорода бутана C4H10 имеет прямую (нормальную) цепь. Второй изомер – изобутан – разветвленную цепь атомов углерода.
Для углеводорода пентана C5H12 различия в последовательности связи углеводородных атомов приводят к образованию трех изомеров:
нормальный пентан изопентан
СН3—СН2—СН2—СН2—СН3 СН3—СН—СН2—СН3
СН3 ½
½ СН3
тетраметилметан СН3—С—СН3
½
СН3
С увеличением числа атомов углерода в молекуле резко возрастает число изомеров. Известны все 9 структурных изомерных гептанов C7H16, предсказанных теорией химического строения. Для углеводородов C10H22 возможно 75 структурных изомеров, для C11H24 159 изомеров, для C12H26 802 изомера, для C14H30 1858 изомеров, для – C20H42 366319 изомеров.
Явление изомерии – одна из важнейших причин существования большого числа органических соединений.
Свойства органических соединений зависят от присутствия – функциональных групп (—ОН у спиртов; >С=О у альдегидов и кетонов; —СООН у карбоновых кислот; —NH2 у аминосоединений; F, Cl, Br, J у галогенпроизводных и так далее). Функциональные группы обуславливают важнейшие свойства и прежде всего химическое поведение молекул. Изучение спектров молекул показало, что функциональные группы имеют характеристические частоты, мало отличающиеся для отдельных представителей каждого класса органических соединений.
Изомерия характерна не только для линейных, но и для циклических молекул:
СН3
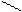
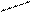 Циклогексан СН2 метилциклопентан ½
Циклогексан СН2 метилциклопентан ½
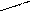
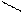

 СН2 СН2 СН
СН2 СН2 СН

 СН2 СН2
СН2 СН2
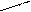
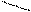 СН2 СН2
СН2 СН2
СН2 СН2—СН2
Структурная изомерия может иметь место и при одинаковом углеродном скелете, если функциональные группы занимают различное положение в молекуле. Порядок связи атомов в молекуле пропана выражается одной структурной формулой: CH3—CH2—CH3. Замещение одного из атомов водорода пропана гидроксильной группой приводит к получению двух изомерных спиртов:
CH3—CH2—CH2OH (1) CH3—CHOH—CH3 (2)
пропиловый спирт изопропиловый спирт
Эти структурные изомеры отличаются положением в молекуле функциональной гидроксильной группы, характерной для класса спиртов.
Дата добавления: 2015-08-08; просмотров: 1139;
