Теории образования и строения ДЭС.
Существование двойного электрического слоя (ДЭС) ионов и скачка потенциала на границе раздела двух фаз играет важную, а иногда – основную роль во многих явлениях важных для теории и практики. К ним относятся: электродные процессы, электрокапиллярные и электрокинетические явления, явления связанные с электростатическим взаимодействием коллоидных частиц, в значительной степени определяющие устойчивость дисперсной системы. Все эти явления, взаимосвязанные посредством ДЭС, называются электроповерхностными.
Рассмотрим явление, имеющее место на границе раздела фаз – возникновение двойного электрического слоя, обусловливающего различные электроповерхностные явления.
Различают три возможных механизма образования ДЭС:
- в результате перехода ионов или электронов из одной фазы в другую (поверхностная ионизация);
- в результате избирательной адсорбции в межфазном слое ионов электролитов;
- в результате ориентирования полярных молекул сопряженных фаз при их взаимодействии.
По первому механизму, заряд на поверхности может образовываться в результате электролитической диссоциации молекул поверхности твердой фазы, в результате чего ионы одного знака остаются в фиксированном положении на этой поверхности, а противоионы (ионы противоположного знака) поступают в прилегающий раствор. По такому механизму ДЭС возникает в растворе целого ряда высокомолекулярных соединений.
По второму механизму, ионы одного знака необменно адсорбируются поверхностью, а ионы противоположного знака, в силу электростатического притяжения, располагаются около нее. Величина и знак заряда поверхности зависит от природы твердых частиц адсорбента и от природы жидкости, с которой он соприкасается.
Рассмотрим схемы строения ДЭС согласно различным теориям.
Впервые представление о ДЭС было высказано Квинке (1859) и развито в работах Гельмгольца (1879).
Теория ДЭС получила развитие в трудах ученых СССР А.Н. Фрумкина и Б.В. Дерягина.
Первой теорией строения ДЭС была теория Гельмгольца: ДЭС состоит из двух плоских зарядов, расположенных на молекулярном расстоянии один от другого и взаимодействующих между собой только за счет электростатических сил притяжения. Структура подобна плоскому конденсатору, падение потенциала между слоями происходит линейно.
Модель Гуи-Чепмена предполагала диффузионное расположение противоионов, находящихся под воздействием сил, действующих в противоположных направлениях: электростатических сил притяжения к поверхности и сил теплового движения ионов, приводящих к диффузии и размыванию внешнего слоя. Теория вводит понятие диффузионного слоя, ионы рассматриваются как точечные заряды, не имеющие собственных размеров.
По современным представлениям (теория Штерна) строение ДЭС представляется следующим образом: ионы входящие в состав твердой фазы, образуют внутреннюю обкладку двойного слоя; ионы противоположного знака, т.е. противоионы образуют внешнюю обкладку, при этом часть противоионов находится в непосредственном соприкосновении с ионами твердой фазы, образуя плотный слой (слой Гельмгольца, адсорбционный слой), другая часть противоионов составляет диффузный слой (слой Гуи).
Система в целом всегда является электронейтральной, то есть число зарядов внутренней обкладки должно быть равно числу зарядов противоионов (плотный слой + избыток в диффузном слое).
В пределах ДЭС действует электрическое поле, интенсивность которого характеризуется значением потенциала. Изменение потенциала в ДЭС в зависимости от расстояния показано на рис. 4.1.
При этом падение потенциала в пределах плотного слоя происходит линейно, а в диффузном слое – по экспоненте.
В настоящее время учение о ДЭС продолжает развиваться, т.к. оно имеет большое значение для понимания и усовершенствования таких практически важных процессов как коагуляция коллоидов, флотация, ионный обмен и др.
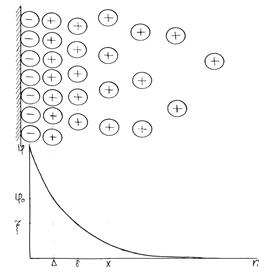
Рис. 4.1. Схема строения двойного электрического слоя и изменение потенциала.
Образование двойного слоя ионов приводит к появлению определенных электрических потенциалов на границе твердой и жидкой фаз.
На твердой поверхности возникает заряд, называемый φ-потенциал.
Знак φ-потенциала совпадает со знаком заряда потенцалобразующих ионов.
φ-потенциал можно рассчитать по уравнению Нернста:
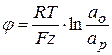 ,
,
где 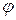 - электрический потенциал на поверхности;
- электрический потенциал на поверхности;
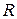 - универсальная газовая постоянная;
- универсальная газовая постоянная;
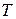 - абсолютная температура;
- абсолютная температура;
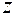 - заряд потенциалобразующих ионов;
- заряд потенциалобразующих ионов;
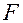 - постоянная Фарадея (
- постоянная Фарадея (  )
)
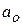 и
и 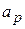 - активность ионов на поверхности и в растворе.
- активность ионов на поверхности и в растворе.
φ-потенциал равен работе переноса единичного (элементарного) заряда из бесконечно удаленной точки объема раствора на поверхность твердой фазы.
Дата добавления: 2015-08-08; просмотров: 4769;
