АРОМАТИЧНОСТЬ.
В 1825г. Майкл Фарадей из светильного газа выделил новое вещество со своеобразным сильным запахом. Он назвал это вещество бензолом. В 1834 году Эрих Митчерлих получил бензол декарбоксилированием бензойной кислоты и установил его эмпирическую формулу (СН)n или СnНn. Измерением плотности паров бензола была установлена молекулярная формула бензола С6Н6.
Судя по молекулярной формуле бензол должен быть ненасыщенным соединением. Однако его химические свойства не соответствовали свойствам ненасыщенного соединения. Были только некоторые исключения из общего правила. Так бензол не реагировал с галогеноводородами, но зато вступал в реакции с азотной кислотой с образованием продуктов замещения. Бензол при нагревании до температуры 7000С оставался устойчивым и не подвергался окислению или пиролизу. На бензол и его гомологи не действовал на холоду разбавленный раствор перманганата калия. На сам бензол также не действовал концентрированный раствор перманганата калия при нагревании, а у его гомологов окислялся алкильный радикал с образованием бензойной кислоты.
Общая тенденция в химических свойствах бензола заключалась в том, что бензол инертен в реакциях присоединения и активен в реакциях замещения, причем в таких реакциях, где в роли атакующего реагента выступает электрофильная частица.
Ненасыщенные соединения инертные в реакциях присоединения и активные в реакциях замещения были названы «ароматическими». Название сложилось исторически. За специфический запах, а также то, что призводные выделены из душистых природных веществ.
В 1865г. Фридрих Кекуле предположил, что молекула бензола имеет циклическое строение. Внутри цикла атомы углерода связаны чередующимися двойными и простыми связями:
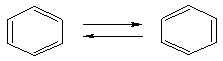
Однако для подобных структур должна была наблюдаться разница в свойствах дизамещенных производных бензола:

Однако подобное различие не наблюдалось.
В 1930г американский ученый Майкл Дьюар предложил рассматривать бензол как совокупность резонансных структур:

Возможность представления молекулы в виде резонансных структур указывает на высокую степень делокализации электронной плотности в молекуле бензола. Мы знаем, что чем выше степень делокализации электронной плотности тем выше устойчивость молекулы. Тезис о повышенной устойчивости молекулы бензола подтверждают расчеты для теплоты гидрирования. Так теплота гидрирования циклогексена:
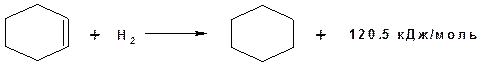
Если бы бензол содержал три изолированные связи, то его теплота гидрирования составила бы:
120.5 × 3 = 361.5 кДж/моль
Однако экспериментальное значение теплоты гидрирования бензола значительно ниже:
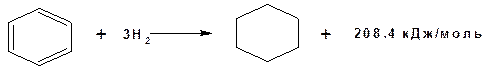
Разность теплоты гидрироваания гипотетического 1,3,5-гексатриена с изолированными двойными связями и реальным бензолом равная:
361.5 – 208.4 = 153.1 кДж/моль
называется энергией стабилизации. Энергия стабилизации обусловлена высокой степенью сопряжения или делокализации π-электронов в пределах циклической структуры.
Определение: Углеводороды циклического строения, обладающие системой чередующихся двойных и простых связей и обладающих повышенной стабильностью – называются ароматическими углеводородами. Свойство повышенной стабильности углеводородов циклического строения, обладающих системой чередующихся двойных и простых связей называется ароматичностью.
Ароматические углеводороды еще называют аренами.
Ароматические соединения обладают особым свойством – они подчиняются так называемому правилу Хюккеля или правилу ароматичности: ароматическими являются органические соединения плоского строения, содержащие сопряженную систему, которая включает 4n+2 π-электрона в цикле.
Для n=0 цикл должен содержать 2 π-электрона. Такому условию удовлетворяет циклопропенил-катион:

Для n=1 цикл должен содержать 6 π-электронов. Такому условию удовлетворяют:
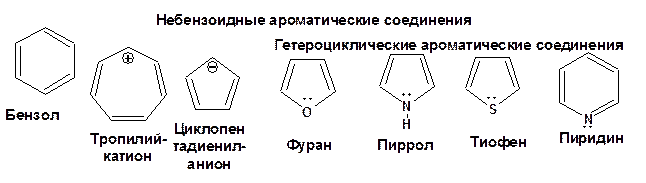
Для n=2 цикл должен содержать 10 π-электронов. Такому условию удовлетворяет:
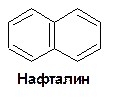
Для n=3 цикл должен содержать 14 π-электронов. Такому условию удовлетворяют:

Дата добавления: 2015-08-01; просмотров: 841;
