Симптомокомплекс инсульта
Особенности начала заболевания наряду со специфической объективной и субъективной неврологической симптоматикой позволяют предполагать локализацию поражения мозга и его причину. В большинстве случаев внезапное острое появление очаговых неврологических симптомов свидетельствует о возможном инсульте, особенно если эти нарушения соответствуют определенному сосудистому бассейну. Так, гемипарез и афазия ассоциируются с поражением бассейна средней мозговой артерии доминантного полушария, а внезапное выпадение полей зрения — задней мозговой артерии; развитие «чистого» гемипареза позволяет предполагать небольшой «лакунарный» инсультный очаг в области внутренней капсулы или основания мозга, соответствующий бассейну мелких пенетрирующих ветвей соответственно средней мозговой или основной артерии. В начале болезни симптомы выражены умеренно или сильно, имеют флюктуирующий характер, постепенно они сглаживаются или нарастают. Именно динамика неврологических симптомов позволяет судить о тромботическом, эмболическом или геморрагическом характере поражения. Но, например, внезапная глубокая кома может наступать как при эмболии основной артерии, так и при субарахноидальном кровоизлиянии или кровоизлиянии в основание моста при артериальной гипертензии. Для выяснения природы поражения, приводящего к коме, необходимо учитывать обнаруживаемую при осмотре неврологическую симптоматику и ее динамику. Однако установить точно детали этой динамики на ранних стадиях болезни довольно сложно. Больной часто не в состоянии припомнить их без подсказки; иногда состояние больного определяется локализацией поражения, как, например, при анозогнозии в случаях поражений недоминантного полушария. Часто важные анамнестические сведения удается выяснить у членов семьи больного.
Таким образом, диагноз симптомокомплекса инсульта основывается на динамике клинической картины и характерном наборе субъективных и объективных симптомов.
При геморрагических инсультах локализация и величина кровоизлияний, а также их тип (субарахноидальное или внутримозговое) определяют характерный симптомокомплекс инсульта. Между тем клиника ишемического инсульта зависит не только от характера патологического процесса, размеров очага, локализаций сосудистого поражения, но еще и от возможностей коллатерального кровоснабжения. Нередко величина коллатерального кровотока достаточна для предотвращения инфаркта или значительного уменьшения его размеров, что влияет на развитие симптомокомплекса инсульта.
Коллатеральный кровоток может оказаться достаточным для того, чтобы полная окклюзия крупного артериального ствола не сопровождалась неврологической симптоматикой и видимыми повреждениями паренхимы мозга. В других случаях закупорка крупной артерии может привести к размягчению ткани мозга во всем бассейне кровоснабжения. Существует множество вариантов очагов инфаркта, различающихся по размерам, форме, стадии развития, что определяется возможностями коллатерального кровоснабжения (см. рис. 343-1). Коллатеральный кровоток зависит от анатомии сосудов, скорости окклюзии, показателей системного кровяного давления. Эти факторы, а также, возможно, и другие, такие как нарушения вязкости, полицитемия, патология эритроцитов, периодически могут действовать неблагоприятно и приводить к ишемии в бассейнах кровоснабжения частично окклюзированных артерий.
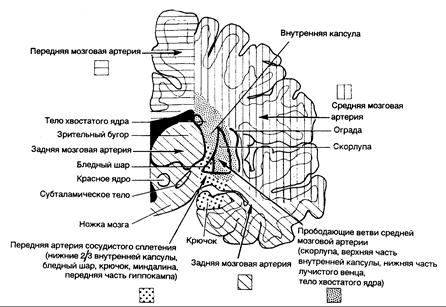
Рис. 343-3. Схема полушарий головного мозга (венечный срез); показаны области кровоснабжения основных сосудов мозга.
Коллатеральный кровоток не влияет лишь на глубокие пенетрирующие сосуды, идущие из ствола средней мозговой артерии (артерии чечевицеобразного ядра и полосатого тела), дистальные отделы позвоночных артерий, основную артерию и артерии виллизиева круга (см. рис. 343-2; рис. 343-3). Они снабжают кровью глубокое белое и серое вещество ствола мозга, зрительных бугров, подкорковых узлов и лучистого венца. Закупорка одного из этих мелких пенетрирующих сосудов как атеротромботического характера, так и при липогиалинозе и эмболиях приводит к развитию малых «лакунарных» инфарктов.
Термины «инсульт в развитии» (называемый также прогрессирующим инсультом) и «завершенный инсульт» необходимо упомянуть особо. Если неврологический дефицит нарастает или носит флюктуирующий характер, что отмечают в процессе наблюдения за больным, говорит об инсульте в развитии; если же дальнейшего нарастания симптоматики не происходит, говорят о завершенном инсульте. Прогрессирующее течение инсульта объясняют несколькими механизмами, среди которых нарастающее сужение артерии тромбом, развитие отека мозга, распространение тромба с облитерацией ветвей коллатерального кровоснабжения к ишемизированному мозгу, а также системные факторы, например артериальная гипотензия. Хотя в некоторых случаях эти факторы могут играть определенную роль, более вероятно, что флюктуирующий неврологический дефицит является результатом множественного распространения, миграции, лизиса и рассеивания эмболов или вызван повторными эмболиями артериоартериального характера или колебаниями коллатерального кровотока через виллизиев круг, анастомозы зон смежного кровоснабжения и орбитальные либо цервикально-вертебральные коллатерали (см. рис. 343-1, а, б, в и 343-2).
Факторы риска инсульта. Предположение об определенных формах поражений сосудов мозга возникает не только при различных симптомокомплексах инсульта, но также при их сочетании с факторами риска. Развитие атеротромботического инсульта часто позволяет думать о том, что у больного имеет место бессимптомное или клинически проявляющееся сосудистое заболевание с поражением коронарных и периферических сосудов. С другой стороны, тяжелое атеротромботическое поражение сосудов любой локализации дает основание рассматривать атеротромботический процесс в качестве причины ишемического инсульта. Если у больного диагностированы фибрилляция предсердий, поражение клапанов сердца, инфаркт миокарда или бактериальный эндокардит, являющиеся источником эмболов, то их наличие указывает на эмболический характер инсульта. Выраженной артериальной гипертензии неизменно сопутствуют липогиалиноз мелких сосудов, лакунарные инсульты и атеротромботическое поражение бифуркации сонной артерии, ствола средней мозговой артерии, сосудов вертебрально-базилярной системы. Гипертензия также предрасполагает к возникновению глубоких внутримозговых кровоизлияний. По утверждению некоторых авторов, проведение антигипертензионной терапии служит важнейшим фактором снижения частоты инсульта. Курение и семейная липемия, хотя и реже, чем гипертензия, сочетаются с повышенным риском атеросклероза и, в частности, с ишемической болезнью мозга.
Симптомокомплекс транзиторной ишемической атаки (ТИА)
Клинические проявления и временной профиль ТИА позволяют судить о природе и локализации лежащей в ее основе артериальной патофизиологии. Термином «транзиторная ишемическая атака» обычно обозначают любой внезапно возникший очаговый дефицит, полностью регрессировавший менее чем за 24 ч. Это определение слишком широкое, так как включает очень много синдромов, причем некоторые из них необязательно вызываются ишемией, например синдром фокальной эпилепсии или приступ мигрени, сопровождающиеся неврологическими симптомами. Кроме того, симптомы ишемии, сохраняющиеся дольше одного часа, могут свидетельствовать о том, что определенный участок ткани мозга подвергся инфаркту.
Специфические симптомы ТИА свидетельствуют о вовлечении в патологический процесс области, снабжаемой кровью определенной артерией [сонная, средняя мозговая, вертебрально-базилярная системы или малая пенетрирующая артерия (лакунарная ТИА)]. Длительность, стереотипный характер и частота повторных эпизодов указывают на их патофизиологические механизмы. Например, повторяющиеся (до 5—10 раз в день), кратковременные (15 мин и менее), однотипные приступы слабости в кисти или всей руке с сопутствующими нарушениями речи или без таковых заставляют думать о проксимальном сужении или окклюзии артерии с недостаточностью коллатерального кровоснабжения, приводящими к преходящей очаговой ишемии («низкий кровоток») коры контралатерального полушария головного мозга. С другой стороны, единственный приступ расстройства речи и слабость в кисти или руке (последнее может отсутствовать) продолжительностью 12 ч можно наблюдать при ишемии мозга, вызванной эмболией, при этом возможно формирование зоны инфаркта в левой лобной доле. Преходящий короткий эпизод чистого пирамидного гемипареза с вовлечением мускулатуры лица, руки, ноги и стопы, не сопровождающийся дисфазией или игнорированием половины тела, свидетельствует о транзиторной ишемии во внутренней капсуле, например в бассейне кровоснабжения одной из мелких пенетрирующих артерий, исходящих из ствола средней мозговой артерии (артерии чечевицеобразного ядра и полосатого тела). При остром нарушении мозгового кровообращения в бассейне этих артерий возникает очаг поражения, размер которого не превышает 1 см, — лакуна. Такое нарушение можно обозначить как «лакунарная ТИА». ТИА в вертебрально-базиллярной системе, если они являются результатом проксимального базилярного или двустороннего дистального стеноза позвоночных артерий, обычно проявляются в виде кратковременных приступов головокружения, двоения в глазах и дизартрии. Повторяемость и кратковременность этих приступов позволяют думать больше о преходящем снижении мозгового кровообращения, чем об эмболии.
В общем, ТИА обусловливаются двумя основными причинами: очаговым снижением кровоснабжения и эмболиями. Механизм возникновения ТИА эмболического генеза очевиден, при этом для назначения лечения необходимо установить лишь источник эмболий. В меньшей степени изучены механизмы развития ТИА в связи с локальным снижением мозгового кровоснабжения. Вероятно, артериальный стеноз или окклюзия критической степени вызывают уменьшение притока крови к определенной области нормального мозга. Важную роль играет недостаточность коллатерального притока крови к зоне ишемии, но в связи с преходящим характером ишемии также необходимо учитывать такие показатели, как вязкость крови, эластичность сосудистой стенки и другие неизвестные пока факторы. Данные формы ТИА лучше рассматривать как истинные ТИА, т. е. как эпизоды неэмболического генеза. В отличие от инсульта проявления ТИА полностью регрессируют, но они служат предупреждением о возможности последующего развития инсульта. Следовательно, патофизиологические механизмы инсульта и ТИА необходимо учитывать совместно. В сущности, врач не в состоянии помочь больному при ТИА, не зная причины, вызвавшей ее. ТИА, как инсульт, представляет собой синдром, требующий постановки более специфического диагноза.
Ишемическая болезнь мозга
Ишемическая болезнь мозга обусловлена сужением или тромбозом артерий на фоне первичного патологического процесса или артериальной окклюзией при эмболиях. В данном разделе речь пойдет о тромбозах мозговых сосудов и их различных патологических причинах. Эмболии сосудов мозга приводят к таким же субъективным и объективным клиническим симптомам, что и тромбозы. Различия в их симптоматологии разбираются в разделе по церебральным эмболиям.
Атеросклеротический тромбоз
Среди многих причин, вызывающих тромбоз сосудов мозга, перечисленных в табл. 343-1, большинство случаев приходится на атеросклеротический тромбоз. Атеросклероз поражает экстра- и интракраниальные артерии специфической локализации. Атероматозные бляшки чаще всего образуются в местах ветвлений и изгибов крупных сосудов, и тромбоз обычно возникает там, где бляшка суживает просвет артерии больше всего.
Детали процесса, сопутствующего развитию тромбоза, недостаточно ясны (см. гл. 195). Само атероматозное поражение располагается между интимой и средней сосудистой оболочкой. Оно пронизывает и разрушает срединную оболочку. Бляшка состоит из гиалиновой соединительной ткани, фибробластов, макрофагов и гладких мышечных клеток. В нее вкраплены очаговые отложения кристаллов холестерина. Предполагается, что тромбоз начинает развиваться тогда, когда атеросклеротический процесс приводит к фрагментации эндотелиальной выстилки сосудистой стенки, создавая тем самым очаг накопления тромбоцитов и образования пристеночного тромба. Иногда протекающая через просвет сосуда кровь рассекает атероматозную бляшку, расслаивает ее. Подобная пенетрация может явиться механизмом образования кратерообразного углубления и стать очагом формирования тромба. Реже к дальнейшему сужению просвета сосуда приводит кровоизлияние в бляшку. Атероматозное сужение сосуда по своей конфигурации напоминает песочные часы с длиной самого узкого сегмента 1—2 мм. Внутрисосудистый тромбоз может развиться как в области данного сегмента, так и проксимальнее или дистальнее от него. Тромботическая окклюзия обычно наступает, когда атеросклеротическая бляшка суживает просвет сосуда настолько, что препятствует току крови в его дистальный отрезок.
Трудно предсказать, какое поражение мозга вызовет атеросклеротический тромбоз. На клиническую картину могут повлиять доступный коллатеральный кровоток, темп тромботической окклюзии, появление эмболий дистальнее области тромбоза. Картина при закупорке определенной артерии варьирует у различных больных, при этом большинство синдромов имеет парциальный характер. Приводимые описания характеризуют инфаркт и ишемию в бассейнах кровоснабжения отдельных артерий при тромбозе, но сходная клиника наблюдается также после эмболий. Иногда кровоизлияние в пределах того или иного сосудистого бассейна может давать близкую симптоматику.
Таблица 343-1. Причины тромбозов сосудов мозга
I. Атеросклероз
II. Тромбофлебит сосудов мозга: вторичный при инфекционных процессах в ухе, придаточных пазухах носа, области лица и т. д.; при менингитах и субдуральной эмпиеме; состояниях истощения, в послеродовом, послеоперационном периодах; сердечной недостаточности; гематологических заболеваниях (полицитемия, серповидно-клеточная анемия) и при невыясненных причинах
III. Артерииты
А. Менинговаскулярный сифилис, вторичный артериит при гнойном и туберкулезном менингитах, редких заболеваниях [тиф, шистосомоз, обусловленный mansoni, малярия (?), трихинеллез (?), мукороз и т.д.] Б. Болезни соединительной ткани: полиартериит (некротизирующий, гранулематозный, аллергический, Вегенера), височный артериит, болезнь Такаясу, гранулематозный артериит аорты, системная красная волчанка
IV. Гематологические нарушения: полицитемия, серповидно-клеточная анемия, тромботическая тромбоцитопеническая пурпура и т. д.
V. Травма сонной артерии
VI. Расслаивающая аневризма аорты
VII. Системная гипертензия: «простой обморок», острая кровопотеря, инфаркт миокарда, синдром Морганьи—Адамса—Стокса, травматический и хирургический шок, сенситивный каротидный синус, выраженная постуральная гипотензия
VIII. Осложнения артериографии
IX. Мигренозная аура с персистирующим дефицитом
X. Синдром вклинения в отверстие мозжечкового намета, большое затылочное отверстие, фальциального вклинения
XI. Гипоксия
XII. Различные причины: радиоактивное или рентгеновское облучение, боковое сдавление внутримозговой гематомой, инфаркт в бассейне средней мозговой артерии с невыясненным механизмом развития при закрытой черепно-мозговой травме, сдавление неразорвавшейся мешотчатой аневризмой, внутрисосудистый тромб при веретенообразной аневризме, локальное расслаивание сонной или средней мозговой артерии, осложнение приема пероральных контрацептивов
XIII. Невыясненные причины, например в детском возрасте
Атеротромботическое поражение внутренней сонной артерии и ее ветвей
Патофизиология. В каротидной системе атеросклеротическое поражение с сопутствующим тромбозом, вызывающее ТИА или инсульт, чаще всего развивается в начале сосуда и реже в области сифона (S-образный отдел внутренней сонной артерии в кавернозном синусе) или в проксимальном сегменте (стволе) средней или передней мозговой артерии. Реже оно отмечается в месте выхода общей сонной артерии. Данные о возникновении атеросклеротического стеноза или ульцеративных изменений перечисленных локализаций до возникновения клинических проявлений остаются неизвестными. Предполагается, что чаще болезнь прогрессирует.
Начало внутренней сонной артерии. Атеросклеротическое поражение проксимального отдела внутренней сонной артерии обычно наиболее выражено на протяжении первых 2 см и локализуется на задней стенке; часто оно распространяется книзу в дистальный участок общей сонной артерии. Часто (в 50—80% случаев) такое поражение дает о себе знать развитием малого инсульта или ТИА, вызванными критическим снижением кровотока или эмболиями из сонной артерии в ее интракраниальные ветви. Клинический опыт и данные патологоанатомических исследований позволяют считать, что инсульты при поражении сонной артерии чаще обусловлены эмболиями, чем дефицитом кровотока. Эмболии из атеросклеротической бляшки, расположенной в начале внутренней сонной артерии, Mогут вызывать ТИА, но если они повторяются, кратковременны и стереотипны, то более вероятной их причиной служат расстройства гемодинамики.
Ишемия мозга, вызванная дефицитом кровоснабжения. Слабый артериальный кровоток может приводить к развитию инфаркта мозга или ТИА в пограничной зоне или в областях смежного кровоснабжения (см. рис. 343-1 а). Их развитию способствуют два условия. Во-первых, снижение кровяного давления дистальнее стенозирующего поражения сонной артерии при уменьшении диаметра ее просвета более чем на 80% или, что равносильно этому, при величине диаметра резидуального просвета менее 1,5—2 мм. Во-вторых, это недостаточность коллатерального кровотока к области ишемии. Нарушение мозгового кровообращения обычно возникает при неполноценности виллизиева круга в связи с врожденной атрезией начального (Al) отдела передней мозговой артерии либо передней или задней соединительных артерий (см. рис. 343-2,6). Реже поражение мозга развивается при окклюзии контралатеральной сонной или основной артерии, ограничивающей приток крови в виллизиев круг. Иногда достаточное поступление крови обеспечивается через глазничные коллатерали из наружной сонной артерии (см. рис. 343-1, б) или поверхностные кортикальные коллатерали на границе артериальных бассейнов (см. рис. 343-1, а). При этом кровоснабжение становится адекватным и область ишемии ограничивается даже при имеющейся неполноценности виллизиева круга. Именно вариабельностью коллатерального кровоснабжения обусловливается разнообразие локализации поражений при инсультах и ТИА в системе сонной артерии на фоне недостаточного кровотока.
Существуют и другие объяснения патофизиологии ТИА при снижении мозгового кровотока. Полагают, что выраженные стенозирующие поражения в области бифуркации общей сонной артерии могут приводить к интермиттирующей окклюзии сосуда в связи со спазмом. В редких случаях системные гемодинамические факторы приводят к снижению кровотока через участок грубого стенозирующего поражения до критических значений. С другой стороны, регионарная циркуляция в полушарии мозга может меняться в связи с поддержанием сниженного кровотока в каротидной системе, и преходящая декомпенсация данного механизма может провоцировать ТИА. Другие факторы, включая истинную полицитемию, тромбоцитемию, сердечную аритмию, иногда вызывают повторные ТИА на фоне недостаточного кровотока.
Эмболии. При происхождении эмболов из стенозирующего или изъязвленного участка атеросклеротического поражения в начале внутренней сонной артерии (локальные или артериоартериальные эмболии) проявляющиеся симптомы обычно связаны с окклюзией глазной артерии, ствола средней мозговой артерии, одной или нескольких ее ветвей и иногда передней мозговой артерии или ее ветвей. Размеры эмбола соответствуют калибру сосуда, который подвергается окклюзии. Малые тромбоцитарные эмболы закупоривают самые дистальные ветви средней мозговой артерии или глазничной артерии, вызывая преходящую слепоту на один глаз (amaurosis fugax) или мелкие бессимптомные инфаркты в зонах смежного кровоснабжения артерий мозга. Более крупные эмболы, состоящие из тромбоцитарно-фибриновых сгустков, могут закрывать первичные и вторичные ветви средней мозговой артерии; при этом дискретные неврологические синдромы позволяют судить о вовлечении в патологический процесс тех или иных областей мозга. Некоторые эмболы настолько велики, что блокируют проксимальный «ствол» средней мозговой артерии, вызывая тяжелую ишемию всей области кровоснабжения средней мозговой артерии (глубокое белое вещество, чечевицеобразное ядро, поверхность коры). Другие эмболы, достаточно крупные для того, чтобы окклюзировать ствол средней мозговой артерии, могут вызвать лишь глубинный инфаркт при наличии достаточного коллатерального кровотока через поверхностные кортикальные сосуды (см. рис. 343-1, а). Большой эмбол, перекрывающий крупный сосуд, может перемещаться, лизироваться и расщепляться. Если расщепление наступает быстро, то неврологический дефицит может быть флюктуирующим или полностью исчезать.
У отдельных больных, имеющих неврологическую симптоматику, поражение сосудов может быть представлено единственной бляшкой в области бифуркации сонной артерии, но гораздо чаще обнаруживается стеноз с резидуальным диаметром просвета сосуда менее 2 мм. Частота массивных эмболических инфарктов, развивающихся исключительно на фоне изъязвления участка атеросклеротического поражения, остается невыясненной. Возможно, она низка, и подобные случаи наблюдаются лишь при больших язвах (4 мм и более). Развитие инсульта или единичной ТИА с длительно сохраняющейся симптоматикой при отсутствии стенозирующего поражения сонной артерии или незначительной его выраженности дает основание предполагать, что источником эмбола является сердце. Атероматозные поражения, локализующиеся в начале крупных ветвей дуги аорты, также могут быть причиной эмболий в сосуды мозга и вызывать его преходящую ишемию или инфаркт, но частота встречаемости данного механизма также не установлена.
Окклюзия внутренней сонной артерии в ее начальном участке может протекать совершенно бессимптомно при адекватном уровне коллатерального кровотока через виллизиев круг. С другой стороны, при недостаточности коллатерального кровоснабжения возможно развитие инсульта или ТИА. Кроме того, тромб способен распространяться вверх от места закупорки через сифон к начальным отрезкам средней и передней мозговых артерий, приводя к инсульту. Но чаще свежие эмболы отрываются от тромботического материала и застревают в средней, передней артериях или в одной из их ветвей. По мнению некоторых авторов, эмболы могут происходить из проксимальной культи внутренней сонной артерии и переноситься через коллатерали наружной сонной артерии, достигая интракраниального отдела внутренней сонной артерии и ее ветвей (см. рис. 343-1, б). Но подобные ситуации, вероятно, достаточно редки.
Причина отсроченного инсульта, развивающегося через несколько месяцев после полной окклюзии сонной артерии, нередко остается непонятной, и ее частота неизвестна. Согласно данным одного из исследований, он встречается в 5% случаев за год. Но с учетом клинического опыта эта цифра представляется завышенной. В большинстве случаев эмболии при окклюзии сонной артерии происходят в течение первого года, хотя их можно наблюдать и в течение двух лет. Инсульты, обусловленные недостаточностью кровоснабжения, развиваются в более ранние сроки, обычно в первые несколько недель после окклюзии сонной артерии.
Интракраниальный отдел внутренней сонной артерии. Каротидный сифон подвергается атеросклеротическому поражению реже, чем проксимальный участок внутренней сонной артерии. Поражения в области сифона могут вызывать инсульты и ТИА, патофизиологические и клинические проявления которых повторяют те, что приведены выше. Анамнестические данные при стенозе сифона неспецифичны. В целом следует учитывать, что стеноз сифона протекает бессимптомно до тех пор, пока атероматозный процесс не уменьшает резидуального просвета до 1,5 мм и менее. Точно диагностировать стеноз каротидного сифона дистальнее глазничной артерии позволяет лишь ангиография. Коллатеральный кровоток через виллизиев круг, несомненно, оказывает влияние на патогенез этих поражений и эффективность их медикаментозного или хирургического лечения.
Средняя мозговая артерия. Атероматозные поражения ствола средней мозговой артерии могут вызывать симптомы ишемии как в связи с сужением просвета артерии, так и в результате закупорки начальных сегментов одной или более артерий чечевицеобразного ядра и полосатого тела, снабжающих кровью глубинное белое вещество и подкорковые узлы. Клинически проявляющаяся атеросклеротическая бляшка редко располагается дистальнее первой бифуркации средней мозговой артерии. Поскольку виллизиев круг находится проксимальнее начала средней мозговой артерии, коллатеральное кровоснабжение в бассейне средней мозговой артерии должно осуществляться через мелкие поверхностные кортикальные сосуды зон смежного кровоснабжения и анастомозы из передней и задней мозговых артерий. Имеющиеся данные свидетельствуют о том, что до развития инфаркта мозга о сужении сосуда обычно «предупреждают» ТИА в бассейне средней мозговой артерии. Их симптоматика сходна с таковой при ТИА, связанных с ухудшением гемодинамики в результате выраженного стеноза внутренней сонной артерии. В противоположность внутренней сонной артерии ствол средней мозговой артерии и одна или более основных ее ветвей обычно подвергаются закупорке эмболом (артериоартериальным, из сердца или из неизвестного источника).
Передняя мозговая артерия. Атероматозные отложения в проксимальном сегменте передней мозговой артерии редко дают выраженную клиническую симптоматику, поскольку окклюзия компенсируется коллатеральным кровотоком через переднюю соединительную артерию. Вероятность ТИА и инсульта повышается, если путь коллатерального кровотока характеризуется врожденной атрезией или в более дистальном участке передней мозговой артерии имеются атероматозные изменения.
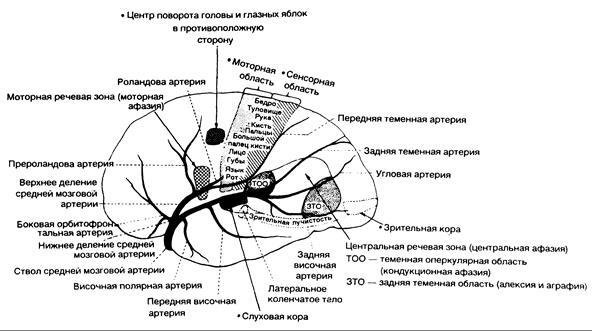
Рис. 343-4. Схема полушария головного мозга (с наружной стороны), показывающая ветви средней мозговой артерии, их распределение и основные корковые центры. Отмечена бифуркация средней мозговой артерии — верхнее и нижнее деления. (Предоставлено Fisher С. М.)
| Клинические проявления | Пораженные структуры | ||
| Контралатеральный паралич мимической мускулатуры, руки, ноги; контралатеральные расстройства чувствительности в области лица, руки и ноги (болевая, вибрационная, мышечно-суставная, чувство прикосновения, локализации, дискриминации, стереогноз, тактильной локализации, давления, двухмерно-пространственное) | Соматомоторная проекция лица, руки и волокна, идущие из зоны проекции ноги, вступающие в лучистый венец и относящиеся к соматосенсорной системе | ||
| Моторная афазия | Моторная речевая зона доминантного полушария | ||
| Центральная афатическая словесная глухота, аномия, жаргонная речь, сенсорная аграфия, акалькулия, алексия, агнозия пальцев, нарушение право-левой ориентации (четыре последних симптома составляют синдром Герстманна) | Центральная речевая зона под сильвиевой бороздой и теменно-за-тылочная кора доминантного полушария | ||
| Кондукционная афазия | Центральная речевая зона (оперкулярный отдел теменной доли) | ||
| Апрактоагнозия при поражении недоминантного полушария (аморфосинтез), анозогнозия, гемиасоматогнозия, одностороннее игнорирование, агнозия левой половины внешнего пространства, «апраксия» при одевании, «конструктивная» апраксия, деформация зрительных координат, неточная локализация в половине поля зрения, утрата чувства дистанции, перевернутое чтение, зрительные иллюзии (например, больному кажется, что по плоскости идет какой-то человек) | Теменная доля недоминантного полушария (область, соответствующая речевой зоне доминантного полушария); потеря топографической памяти обычно обусловлена поражением недоминантного, а иногда — доминантного полушария | ||
| Гомонимная гемианопсия (часто нижнеквадратная гомонимная гемианопсия) | Зрительная лучистость в глубине второй височной извилины | ||
| Паралич взора в противоположную сторону | Центр взора в лобной доле и идущие от него волокна | ||
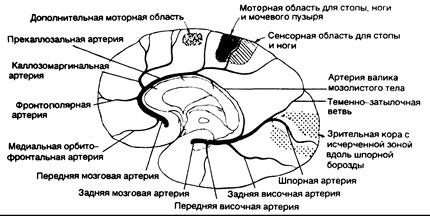
Рис. 343-5. Схема полушария головного мозга (с внутренней стороны), показывающая ветви передней мозговой артерии, их распределение и основные корковые центра. (Предоставлено Fisher С. М., М. D.)
| Клинические проявления | Пораженные структуры |
| Контралатеральный паралич стопы и ноги | Моторная проекция ноги |
| Выраженный в меньшей степени контралатеральный парез руки | Вовлечение области корковой проекции руки и идущих из нее волокон в лучистом венце |
| Кортикальное поражение, приводящее к потере чувствительности в пальцах стопы, стопе и ноге | Сенсорная проекция стопы и ноги |
| Недержание мочи | Сенсомоторная область парацентральной дольки |
| Контралатеральный хватательный, сосательный рефлексы, паратоническая ригидность | Внутренняя поверхность заднего отдела лобной доли (?) — дополнительная моторная область |
| Абулия (акинетический мутизм), медлительность, заторможенность, периодические внезапные заминки, аспонтанность, шепотная речь, двигательная бездеятельность, рефлекторное оживление при воздействии зрительных и звуковых стимулов | Локализация неясна — вероятно, поясная извилина и медиальные отделы теменной и височной долей |
| Нарушения при ходьбе и в положении стоя (апраксия походки) | Лобная кора вблизи моторной проекции ноги |
| Диспраксия в левых конечностях, левосторонняя тактильная афазия | Мозолистое тело |
Клинические синдромы. Средняя мозговая артерия. Кортикальные ветви средней мозговой артерии снабжают кровью боковую поверхность полушария головного мозга, за исключением лобного полюса, полосы, располагающейся вдоль верхневнутренней границы лобной доли, кровоснабжаемых передней мозговой артерией, и нижних височных извилин, относящихся к бассейну задней мозговой артерии (см. рис. 343-3; рис. 343-4, 343-5).
Средняя мозговая артерия снабжает кровью кору и белое вещество с боковой и нижней сторон лобной доли, моторную кору (поля 4 и б, корковые центры взора и в доминантном полушарии — моторный речевой центр Брока), кору и белое вещество боковой поверхности теменной доли (сенсорная кора, угловая и надкраевая извилины), боковую и верхнюю части височной доли и островок (см. рис. 343-3 и 343-4). Прободающие ветви средней мозговой артерии снабжают кровью скорлупу, наружный отдел бледного шара, заднее бедро внутренней капсулы под плоскостью, пересекающей верхнюю границу бледного шара, прилежащую часть лучистого венца, тело хвостатого ядра, а также верхний и боковой сегменты головки хвостатого ядра (см. рис. 343-3).
Эмболическому и тромботическому поражению наиболее часто подвергается бассейн средней мозговой артерии. При полной окклюзии ствола артерии блокируются как прободающие ветви к глубинному белому и серому веществу, так и крупные ветви к поверхности коры. Классическая картина данного поражения характеризуется контралатеральными гемиплегией и гемианестезией. При вовлечении в патологический процесс доминантного полушария наблюдается также тотальная сенсомоторная афазия. В случаях поражения недоминантного полушария клинический симптомокомплекс дополняется апрактоагнозией и анозогнозией (см. рис. 343-4). Если у больного имеется дизартрия, то дисфазии не наблюдается.
Выраженную картину поражения бассейна средней мозговой артерии чаще отмечают при окклюзии ствола артерии эмболом. Для становления эффективного коллатерального артериального кровоснабжения коры необходимо определенное время (см. рис. 343-1 и 343-4), но оно обусловливает развитие частичных синдромов при атеротромботической закупорке ствола средней мозговой артерии. Частичные синдромы поражения бассейна средней мозговой артерии встречаются также при эмболиях. Эмбол может попасть в ствол артерии, распространяться в дистальном направлении, проникать в дистальные ветви и подвергаться лизису. В соответствии с этим процессом объективная и субъективная симптоматика флюктуирует (см. рис. 343-4). Отдельные синдромы, возникающие в результате эмболической окклюзии одной из ветвей, включают слабость в кисти, слабость только верхней конечности (плечевой синдром) или поражение мимической мускулатуры с моторной афазией и слабостью в руке или без таковой (лобный оперкулярный синдром). Нарушение чувствительности, слабость в конечностях и моторная афазия позволяют предположить эмболию в месте выхода ветви из верхнего деления (см. рис. 343-4). При повторной афазии без парезов, вероятно, имеется поражение в области нижнего деления средней мозговой артерии, поскольку выходящие из него ветви снабжают кровью заднюю сенсорную зону доминантного полушария (см. рис. 343-4). Внезапное появление затруднений, обусловленных игнорированием половины тела и пространственной агнозией, при отсутствии паралича свидетельствует о поражении нижнего деления средней мозговой артерии недоминантного полушария.
Передняя мозговая артерия. Передняя мозговая артерия имеет два сегмента: прекоммунальный (Al) виллизиева круга, или стволовой, сегмент, который соединяет внутреннюю сонную артерию с передней соединительной артерией, и посткоммунальный (А2) сегмент, берущий начало от соединения сегмента Al с передней соединительной артерией (см. рис. 343-2). Сегмент А2 передней мозговой артерии через свои кортикальные ветви снабжает кровью передние is медиальной поверхности орбитальной части лобной доли, полюс лобной доли, полосу коры вдоль верхнесрединной границы и передние 7/8 мозолистого тела (см. рис. 343-5). С другой стороны, сегмент Al передней мозговой артерии отдает много глубоких пенетрирующих ветвей, идущих главным образом к переднему бедру внутренней капсулы, переднему продырявленному веществу, миндалевидному телу, переднему гипоталамусу и нижней части головки хвостатого ядра (см. рис. 343-3).
Инфаркты в бассейне передней мозговой артерии встречаются редко. Окклюзия ствола или сегмента Al передней мозговой артерии обычно хорошо компенсируется благодаря возможности коллатерального кровотока от противоположной стороны. Самые тяжелые расстройства возникают в тех случаях, когда обе передние мозговые артерии берут начало из единого ствола, окклюзия которого приводит к возникновению обширного инфаркта в бассейнах передних мозговых артерий обоих полушарий. Клинические проявления включают двусторонние пирамидные нарушения с параплегией и выраженные изменения со стороны психики в связи с двусторонним поражением лобных долей. Компоненты типичного синдрома, развивающегося при закупорке передней мозговой артерии дистальнее виллизиева круга, приведены в примечаниях к рис. 343-5.
Передняя артерия сосудистого с плетения. Эта артерия начинается от внутренней сонной артерии и снабжает кровью заднее бедро внутренней капсулы, а также белое вещество сбоку и позади от нее, через которое проходит часть зрительных волокон от наружного коленчатого тела к шпорной борозде. Однако эта область снабжается кровью также пенетрирующими сосудами, идущими из ствола средней мозговой артерии (артерии чечевицеобразного ядра и полосатого тела), пенетрирующими ветвями задней соединительной артерии и задней артерии сосудистого сплетения. Поэтому полный клинический синдром в виде контралатеральной гемиплегии, гемианестезии (гипестезии) и гомонимной гемианопсии может не развиться; вместо него наблюдаются синдромы с минимальной выраженностью нарушений. Действительно, в случаях хирургической окклюзии артерии с целью лечения симптомов болезни Паркинсона у некоторых больных не обнаруживается признаков дефицита кровообращения в области ее бассейна. Больные, у которых первоначально наблюдался развернутый клинический симптомокомплекс, нередко выздоравливают полностью или частично, по-видимому, благодаря достаточному уровню коллатерального кровотока.
Внутренняя сонная артерия. Клиническая картина окклюзии внутренней сонной артерии варьирует в зависимости от того, что служит причиной ишемии: распространяющийся тромбоз, эмболия или низкий кровоток. Окклюзия может протекать бессимптомно. Обширные инфаркты с вовлечением глубокого серого и белого вещества, кортикальной поверхности развиваются реже, если окклюзирующий тромб распространяется до внутренней сонной артерии и проникает в ствол средней мозговой артерии и переднюю мозговую артерию либо если отделяющийся фрагмент тромба влечет за собой эмболию средней или передней мозговой артерии. Симптоматика идентична таковой при закупорке ствола средней мозговой артерии (см. выше). При одновременном вовлечении в патологический процесс передней и средней мозговых артерий гемиплегии, гемианестезии и афазии или анозогнозии часто сопутствует ступор. Когда задняя мозговая артерия исходит из внутренней сонной (фетальная задняя мозговая артерия), она также может подвергаться закупорке посредством охарактеризованных выше механизмов, что сопровождается симптомами поражения бассейна ее кровоснабжения (см. рис. 343-5; рис. 343-6).
При клинически проявляющемся атеротромботическом поражении внутренней сонной артерии независимо от причины ишемии в ее бассейне чаще всего страдает лишь область, кровоснабжаемая средней мозговой артерией. Инфаркт, обусловленный низким кровотоком, нередко локализуется в бассейне дистальных кортикальных ветвей средней мозговой артерии, приводя к развитию преходящей или постепенно нарастающей слабости в мышцах тазового и плечевого поясов и верхней конечности. Иногда наблюдаются транзиторные эпизоды ишемии, сопровождающиеся дисфазией или гемипарезом длительностью 10—15 мин с последующим регрессом этих симптомов. Максимальное число подобных эпизодов в сутки достигает 5—10. При вовлечении доминантного полушария можно наблюдать преходящую афазию или дискалькулию. При вовлечении в процесс недоминантного полушария может наступать транзиторное игнорирование половины тела. При поражении в области нижнего деления средней мозговой артерии доминантного полушария отмечаются выраженные афазические расстройства с беглым жаргоном, при этом письменную и устную речь больного понять невозможно (афазия Вернике) (см. гл. 22). Даже при артериоартериальных эмболиях симптоматика часто носит флюктуирующий характер в связи с тем, что эмболы способны вызывать неполную окклюзию ствола или ветвей средней мозговой артерии или подвергаться лизису и переноситься в дистальном направлении. В большинстве случаев оказывается, что если симптоматика удерживается достаточно долго, но менее 24 ч, то она обусловлена эмболией. В тех же случаях, когда симптом носит транзиторный характер и сохраняется лишь несколько секунд или минут, обычно сложно провести разграничение между эмболической и гемодинамической его природой.
Помимо головного мозга, внутренняя сонная артерия снабжает кровью зрительный нерв и сетчатку посредством глазной артерии (см. рис. 343-1). Примерно в 25% случаев клинически проявляющейся окклюзии внутренней сонной артерии эпизодически возникает преходящая слепота на один глаз, предупреждая о возможности ее стабилизации. Описывая подобный эпизод, больной может сообщить врачу об ощущении опускающейся и исчезающей либо пересекающей поле зрения тени или о выпадении периферических отделов полей зрения. Возможны также жалобы на нечеткость, смазанность зрения на пораженный глаз или на отсутствие верхней или нижней половины поля зрения. Чаще эти симптомы сохраняются лишь несколько минут. Реже одновременно с инсультом отмечают окклюзию глазной артерии или центральной артерии сетчатки.
Общая сонная артерия. При закупорке общей сонной артерии можно наблюдать всю симптоматику окклюзии внутренней сонной артерии. При «болезни отсутствия пульса» или синдроме дуги аорты (см. гл. 197) возможна окклюзия обеих общих сонных артерий в местах их выхода. В диагностике данного состояния ведущими являются следующие симптомы: отсутствие пульсации на сонных и лучевых артериях, обмороки при подъеме из горизонтального положения, повторные эпизоды потери сознания, головные боли, боли в шее, преходящая слепота (одно- или двусторонняя) , нечеткость зрения при физической нагрузке, ранние катаракты, атрофия и пигментация сетчатки, атрофия радужки, лейкомы, перипапиллярные артериовенозные анастомозы, атрофия зрительных нервов и/или перемежающаяся слабость жевательной мускулатуры. Нередко наблюдается неполный синдром дуги аорты, состоящий из различных сочетаний стенозов и окклюзий сонных, подключичных и безымянных артерий (см. ниже).
Лабораторные исследования. Для обследования больных с аускультативными шумами над сонной артерией, инсультами или ТИА в каротидной системе существует много диагностических методик. Выявить данные, свидетельствующие о поражении бифуркации общей сонной артерии, и его природу позволяют аускультативное выявление шума над бифуркацией общей сонной артерии в области шеи или над глазным яблоком, а также пальпация артерий на шее, на поверхности лица и лба при сдавлении преаурикулярной артерии (динамическая пальпация лица). Шумы высокого звучания, затухающие во время диастолы, могут указывать на выраженный стеноз начала внутренней сонной артерии. Между тем лишь определенный клинический опыт врача позволит оценить длительность и высоту шума или трудноуловимые изменения напряжения пульса во время динамической пальпации лица. Для более достоверного определения выраженности и локализации атеротромботического поражения сонной артерии разработано несколько неинвазивных тестов.
Неинвазивные методы исследования сонных артерий. Определить давление во внутренней сонной артерии позволяют офтальмодинамометрия, окулоплетизмография и направленное супраорбитальное допплеровское исследование. Эти тесты особенно результативны в тех случаях, когда резидуальный диаметр просвета в месте атероматозного поражения в начале внутренней сонной артерии составляет более 2 мм, что дает нормальные показатели при исследовании, а также тогда, когда резидуальный диаметр становится менее 1 мм, в силу чего давление дистальнее пораженного участка резко снижается.
Исследовать бифуркацию общей сонной артерии позволяют такие неинвазивные методы, как ультразвуковое исследование и количественная спектральная фотоангиография.
Ультразвуковые методы исследования включают В-сканирование в реальном масштабе времени и частотный анализ сигнала возвратного эха от текущей крови. К сожалению, ультразвуковая визуализация обладает ограниченной разрешающей способностью, поскольку кальцификация бляшки препятствует проникновению ультразвукового сигнала, а плотность мягкого тромба примерно такая же, как и текущей крови. Однако при помощи данного исследования можно надежно идентифицировать атероматозные поражения в области бифуркации общей сонной артерии. Поскольку характер кровотока через участок стенозирующего атеросклеротического поражения меняется с ламинарного с постоянной скоростью на ток в направлении обтекания с высокой скоростью и затем на турбулентный ток с широкими колебаниями скорости течения непосредственно дистальнее стеноза, эти изменения могут быть выявлены с помощью таких допплеровских методик, как непрерывно-волновая (нв) или эхо-импульсная с переменной длиной волны. Они отображаются в виде спектрального расширения возвратных эхо-импульсов от допплеровского сигнала. Дуплексное сканирование сочетает в себе исследование артериального В-эха и анализ кровотока в каждом изучаемом участке посредством эхо-импульсации с переменной длиной волны.
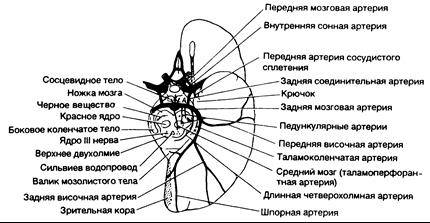
Рис. 343-6. Схема головного мозга (вид снизу), показывающая ветви задней мозговой артерии, их распределение, а также основные анатомические образования. (Предоставлено Fisher С. М.)
| Клинические проявления | Пораженные структуры |
| Периферическая территория бассейна (см. также рис. 343-5) Гомонимная гемианопсия (часто верхнеквадратная) | Кора около шпорной борозды и расположенная поблизости зрительная лучистость |
| Двусторонняя гомонимная гемианопсия, корковая слепота, осознание или отрицание слепоты; тактильное восприятие, ахроматопсия (цветовая слепота), невозможность видеть движения с одного места на другое, неспособность восприятия не центрально расположенных объектов, апраксия движений глазных яблок, неспособность пересчитать или перечислить предметы, больной натыкается на предметы, которые видит и пытается обойти | Двустороннее вовлечение затылочных долей и, возможно, теменных долей |
| Вербальная дизлексия без аграфии, цветовая аномия | Поражение в доминантном полушарии области шпорной борозды и задней части мозолистого тела |
| Нарушения памяти | Поражение гиппокампа — двустороннее или только в доминантном полушарии |
| Топографическая дезориентация и прозопагнозия | Обычно поражено недоминантное полушарие в области шпорной и язычной извилин |
| Сумультагнозия, игнорирование половин полей зрения | Зрительная кора доминантного полушария, противоположное полушарие |
| Неоформленные зрительные галлюцинации, педункулярный галлюциноз, метаморфопсия, телеопсия, иллюзорное зрительное увеличение, расстройство запоминания, зрительные персеверации, искажение контуров, центральная фотофобия | Кора области шпорной борозды |
| Сложные галлюцинации | Обычно недоминантное полушарие |
| Центральная территория | |
| Таламический синдром: утрата всех видов чувствительности, спонтанные боли и дизестезии, хореатетоз, интенционный тремор, спазмы в кисти, легкий гемипарез | Задневентральное ядро таламуса; вовлечение соседнего субталамического тела и его афферентных путей |
| Таламо-перфорантный синдром: перекрестная мозжечковая атаксия и ипсилатеральный паралич III нерва (синдром Клода) | Дентатоталамический тракт и область выхода III нерва |
| Синдром Вебера: паралич III нерва и контралатеральная гемиплегия | III нерв и ножка мозга |
| Контралатеральная гемиплегия | Ножка мозга |
| Паралич или парез движений глаза по вертикали, косоглазие, вялая реакция зрачка на свет, нерезко выраженные миоз и птоз могут сочетаться с ретракционным нистагмом и опусканием век | Супрануклеарные волокна к III нерву, интерстициальное ядро Cajar, ядро Даркшевича и задняя комиссура |
| Контралатеральный ритмичный тремор с атактическими движениями; ритмичный постуральный тремор (рубральный тремор) | Дентатоталамический тракт (?) |
Количественная спектральная фоноангиография позволяет анализировать доступные прослушиванию частотно-силовые компоненты шума от турбулентного потока крови. С ее помощью вычисляют резидуальный диаметр просвета внутренней сонной артерии и разграничивают шум. возникающий в каротидной бифуркации, и шум, распространяющийся из основания сердца. Между тем за шумы из наружной сонной артерии могут быть ошибочно приняты более серьезные шумы из внутренней сонной артерии. Данный тест отличается тем, что дает более точные результаты, если шум исходит из области стенозирующего поражения с величиной резидуального просвета диаметром 0,9—2,5 мм. Следовательно, применять его наиболее целесообразно при таких величинах стенозов, когда другие неинвазивные тесты менее информативны.
Как показывает клиническая практика, оптимальный набор неинвазивных методов должен включать прямое исследование бифуркации общей сонной артерии с помощью дуплексного В-сканирования в сочетании со спектральным анализом частот допплеровского сигнала. При наличии шума рекомендуется проведение фоноангиографии. Окулоплетизмографию применяют в большинстве лабораторий для непрямого измерения давления во внутренней сонной артерии и более точной оценки гемодинамических последствий поражения. Эти тесты наиболее информативны при следующих клинических показаниях: 1) исследование бифуркации общей сонной артерии в тех случаях, когда ишемический инсульт или ТИА неясного генеза развиваются в системе внутренней сонной артерии; 2) контроль за прогрессированием установленного стеноза сонной артерии; 3) обследование при наличии бессимптомного шума. Всем неинвазивным тестам свойственна определенная ошибка измерений (10% в руках опытного исследователя). Кроме того, с их помощью не удается отдифференцировать полную каротидную окклюзию от резко выраженного стеноза начального участка внутренней сонной артерии. Поэтому они менее информативны в тех ситуациях, когда больному, перенесшему малый инсульт или ТИА, необходимо безотлагательно провести соответствующее лечение с целью предупреждения повторных острых нарушений мозгового кровообращения; при этом обычно невозможно обойтись без ангиографии. Недавно была разработана методика эхо-импульсного исследования с переменной длиной волны, которая применяется для определения кровотока в позвоночной артерии и крупных внутричерепных артериях, в том числе стволе средней мозговой артерии, передней и задней мозговых артериях. Эффективность данного метода в документировании нарушений кровотока при поражениях, приводящих к сужению сосудов, еще предстоит подтвердить.
Церебральная ангиография. Наиболее надежным методом исследования сосудистой сети головного мозга служит церебральная ангиография, проводимая путем селективного экстракраниального введения контрастного вещества после трансфеморальной катетеризации. Она позволяет обнаружить ульцеративные поражения, выраженное стенозирование, образование пристеночного тромба в области каротидной бифуркации, дает возможность непосредственно визуализировать расслоение стенки сонной артерии и атеротромботическое поражение сифона и интракраниальных сосудов. С ее помощью можно обнаружить коллатеральный кровоток в виллизиевом круге и на кортикальной поверхности, эмболическую окклюзию ветвей сосудов мозга. Хотя с помощью ангиографии невозможно определить кровоток, она фиксирует некоторые изменения, свидетельствующие о его нарушениях в системе внутренней сонной артерии. Например, интракраниальное русло может заполняться медленнее, чем наружная сонная артерия. Таким образом, церебральная ангиография позволит врачу оценить многие факторы, имеющие отношение к пониманию патофизиологической природы инсульта.
Однако, рассматривая преимущества селективной церебральной ангиографии, следует сказать и о сопряженном с ней риске. Согласно некоторым данным, частота осложнений колеблется от 1,3 до 12%. Особенно часто обсуждается вероятность расслоения стенки аорты и эмболического инсульта. Некоторые авторы считают, что ангиография представляет особый риск для больных с выраженным стенозирующим поражением каротидной бифуркации, другие же полагают, что в руках опытных ангиографистов это исследование относительно безопасно при всех показаниях к нему. Простые превентивные меры в виде дегидратации и гипотензии во время и после проведения ангиографии позволяют предотвратить осложнения, связанные с ишемией мозга. Пациентам с повторяющимися головными болями или мигренозными феноменами в анамнезе перед ангиографией следует назначать кортикостероиды, но их эффективность в предупреждении ишемических осложнений не доказана. В ряде случаев применяют более безопасную методику ангиографии с введением контрастного вещества в плечевую артерию, обеспечивающую столь же полную информацию, что и селективная интракраниальная ангиография при трансфеморальной катетеризации.
Дата добавления: 2015-07-22; просмотров: 1400;
