Дін клеткаларының пайда болуы
| 1-ші кезең | 2-ші кезең | 3-ші кезең |
| Ұрықтандыру және бөлінудің басталуы | Бластоцисталардың пайда болуы | Дін клеткалардың әрі қарай көбейюі |
| Ұрықтандырғаннан кейін бірнеше сағатта тотипотентті клеткалар пайда болады (латын тілінен «барлығын істейтіндер», жаңа организм туындауына басқару қабілеттілігі бар. | 100-150 плюрипотентті клеткалардан құралған күрделі материалдан эмбрион дамиды. Келешекте бластоцистаның сыртқы қабатынан ұрықтың қабы мен плацента пайда болады, ал ішкі құрылымынан өнделетін дін клеткалары адам организмінің барлық клеткалар типтеріне негіз болады. | Дін клеткасы бір дін және келесі даму сатысына өтетін мультипотентті (мамандырылған) клеткаларға бөлінеді (мысалы, сүйек кемігінің ГДК бір дін клеткасы және бір лейкоцит немесе эритроцит пайда болады) |
| ұрықтандыру | аналық дін клеткасы | |
| бөлінудің басталуы | дін клеткалары бластоциста | ерекшелену дін клеткалары нейрон эпидермис клеткасы бұлшықет клеткасы |
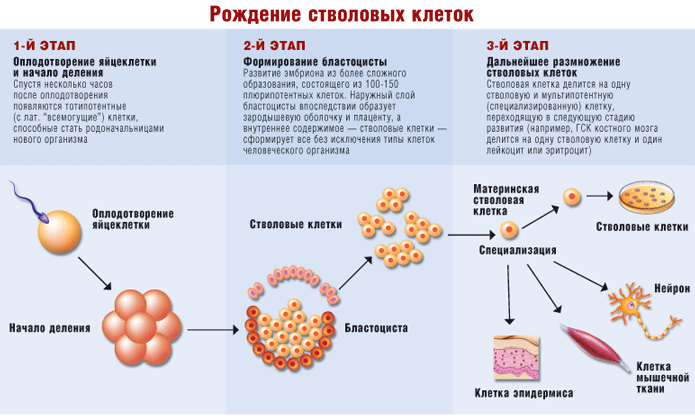 Сурет 10. Дін клеткаларының пайда болуы
Сурет 10. Дін клеткаларының пайда болуы
Ескерту. Эмбрионның дін клеткалары (бластоцит дамуының бірінші 6 тәулігі) экзодерма, мезодерма, эндодерма клеткаларына дифференциациялайды (адам организмінің ағзалары мен тіндерін құрайтын 350 жуық клеткалар типтері), (http || moikompas.ru | img | compass).
Эмбрионның дін клеткалары (ЭДК) үш негізгі сипаттамалармен анықталынады:
- біріншіден, бұл мамандырылмаған клеткалар (бұлшықеттер, ми және т.б. құрайтын клеткалардан тыс айырмашылығы);
- екіншіден, ЭДК ұзақ уақыт бөлінуге қабілетті, және бір бөлінгенде екі бірдей клеткалар пайда болады;
- үшінші, ЭДК маңызды қасиеті, олар арнай клеткалар типтеріне дифференциациялануға қабілетті. Олар үш типті тіндерге дифференциацияланады: ішкі ағзаларға бастау болатын эндодерма; мезодерма (дәнекер тіні, бұлшықеттер, қанайналым жүйесі және сүйек тіні) және эктодерма (тері, сезім ағзалары және нерв клеткалары).
Дін клеткаларын бөліп алу
Эмбрионды дін клеткаларын жасанды ұрықтандыру тәсілімен алуға болады; экстракорпоральды ұрықтандырумен айналысатын клиникалар in vitro-дағыіс шараларына бірден көп ұрықтанған клетка енгізеді, себебі бірінші имплантация ойдағыдай аяқталмауынан ендіруді бірнеше рет қайталайды. Қорытындысында мыңдаған ұрықтанған клеткалар іске аспай қалады, олардан дін клеткаларын алуға қолданады. In vitro-да клондау арқылы эмбрионды қолдануға болады.
Гемопоэтикалық дін клеткаларын негізінен кіндік қанынан алады. Бала туғанда ондаған миллилитр ағатын кіндік қанның құрамында дін клеткалары, ең алдымен ГДК аз көлемде емес кездеседі. Кіндік қанында ГДК жалпы концентрациясы төмен, бірақ алғашқы жас клеткалар саны сүйек кемігінен әлде қалай көп (мысалы, кіндік қанында полипотентті ГДК 2 есе көп, сондай көлемдегі сүйек кемігі трансплантатпен салыстырғанда). Ең алдымен, кіндік қанды арнайы қондырғымен алмайды. Тек бала туғаннан кейін уақытылы стерилді пластикалық контейнерге жинап алған жеткілікті, кейін оны тексеру қажет, сүйық азотта қатырып мұздатқышта сақтайды. Бір алғанда орташа 80-100 мл кіндік қаны жиналады. Трансплантацияға реципиент денесінің 1 кг салмағына орташа 1 мл кіндік қан жарайды. Кіндік қанда дін клеткалары көп емес, егерде тиімді қолданса өз баласының 10 жасына дейін бір рет қолдануға болады.
Дін клеткаларды дақылдандыру жағдайы
Дін клеткаларын дақылдандыру үшін олардың өсуін және тіршілігін созатын барлық қоспалары бар қоректік орталар қолданылады. Орталардың негізі – қышқылды-сілтілі тепе-тендікті (балансты) және осмостық градиентті сақтап тұратын құрамы мен концентрациясы бойынша тандалып алынған минеральды компоненттер. Міндетті түрде құрамында аминқышқылдар, гормондар және басқа да биологиялық активті заттар болу керек. Дін клеткаларын дақылдандыру үшін мүқият температура сақталуы, көмір қышқыл газы/оттегі қатынасы, абсолютті стерильдігі, қатал мезгілді қоректік ортаның ауыстырылуы, күнделікті микроскопиялық бақылауы талап етіледі, және ең маңыздысы, уақытылы егіп отыру, қымбат өсу факторлары мен фетальды сарысу қажет. Нәруыздардың сарысулары құрамында әртүрлі белсендіргіш және тежеуші өсу факторлары бар. Міндетті түрде уақытылы дақылды қайтара егіп отыру керек, себебі флакондағы клеткалар әртүрлі типтегі клеткаларға қайтымсыз дифференцияланып кетуі мүмкін (жүректің бұлшықеттері, сүйек тіні, майлы клеткалар, шеміршек тіні және т.б.).
Биоматериалды (сүйек кемігі, тері, кіндік қаны) міндетті түрде ИФА, ПТР көмегімен жұқпалы аурулар қоздырғыштарына тестілейді.
Кіндік қанның гемопоэтикалық дін клеткалар концентратын алу технологиясы. Кіндік қанды изотониялық антикоагулянты бар стерильді ыдыстарға (шприцтер немесе полиэтилен пакеті) алады, алу барысында материалды ластап алмау үшін мұқият қауіпсіздік және асептика талаптарын сақтау қажет. Материалды бөлме температурасында изотермиялық тасымалдау контейнерінде тасымалданады. Кіндік қанынан дін клеткаларын алу барысында сатылы өнделуден өтеді, нәтижесінде шектен тыс бөлінген плазма, қанның барлық қызыл элементтері және көптеген жетілген лейкоциттерден ажыратылады. Осындай гемопоэтикалық дін клеткалар концентратын бөліп алу тәсілі қымбат болғанымен аса тиімді. Дін клеткаларды сепарация жасауының түрлі әдістері (концентратты алу) қолданылады, солардың ішінде фиколл тығыздығы градиентімен центрифугадан өткізу және гидроксиэтилкрахмалмен седиментация жасау.
Дін клеткалар концентраттарын аутологиялық плазмада криогенді түрде сақтау үшін оларды криопробиркаларға өлшеп орайды және 900С температураға дейін 10% ДМСО қоса мұздатып қатырады да сұйық азотта сақтайды. Сынақ түрінде қайтара жібіткен (валидация) тірі клеткалар 80% құрайды.
Адамның мезенхималық дін клеткаларын бөліп алу және дақылдандыру
Мезенхималық дін клеткаларды (МДК) бөліп алу үшін адамның сүйек кемігі мен май тіндері қолданады, олардан «терапиялық дозадағы» клеткаларды алу үшін жануарлардың (мүмкін болса кіндік қанның аутологиялық сарысуы қолданылады) қан сарысуы бар арнайы қоректік орталарға дақылдандырады. Пассаж арасындағы интервал 7-9 тәулік, 100 млн МДК алуына 6 апта өсіру қажет. Келесі 2-3 апта өсуінде клетканың массасы 100 есе көп өседі. Қан өнімдеріне қойылатын талаптарды және өндірістің асептикалық жағдайын сақтай отырып клиникада сұранысқа ие адам клеткаларының тиімді дақылдандыру технологияларын өндеу қажет. Аллогенді МДК клиникада қолдануына шектеу қоятындығы бұл дақылды ортада оларды өсіруі міндетті. Және де қоректік орталар құрамына жануарлардың қан сарысуы жоғары концентрацияда болуы (бұзау, жылқының және басқалардың да ұрық қансарысуы), атақты өндірушілер әр дайым сарысуларды тестілеп отырғанымен пациентті прионды және зоонозды инфекциямен жұқтыру қауіпі бар. Келесі қауіпі пациенттің ксеногенді нәруыздармен иммунизациясы (сенсибилизациясы) жүруі, әсіресе осындай клеткалық материалды екінші рет қайтара енгізгенде. Біріншісі де екіншісі де адамның МДК дақылдандыруының альтернативті жолдарын қарастыруын талап етеді.
Дін клеткаларды қолдану
Дін клеткаларының трансплантациясы бірнеше қатар тұқымқуалайтын және жүре пайда болған аурулар емдеуінің заманауи әдісіне тұрақты енді. Онкологиялық және гематологиялық аурулары бар науқастардың қанайналымын қалпына келтіру үшін оң жылдар астам ГДК қолданылып келеді.
Миокард инфаркті және жүректің созылмалы жетіспеушілігін емдеуіне МДК қолдану технологиясы өнделуде.
2007 жылы желтоқсан айында Осаки Университеті ауруханасы қызметкерлері пациенттің қанқа бұлшықетінен алынған миобласт клеткаларын ауыстырып салу арқылы миокард инфарктімен сырқаттайтын адам миокардының қысқартылу қабілеті қалпына келтіру бойынша клеткалық терапияның (аутологиялық дін клеткаларымен) нәтижелі аяқталуын хабарлаған. Қорытындысы нәтижелі болғандықтан дәрігерлер жүректі ауыстырып салуын алғашында жоспарлаған іс әрекеттеріне бас тартты. Миокард инфарктінен кейінгі клеткалық терапия өзінің ұзаққа созылған нәтижесін берді. Сонымен қатар, миокард инфарктінде сүйек кемігінің аутологиялық ДК концентратын коронарішілік инфузия көмегімен жасалған клеткалық терапия тәсілі клиникалық сынақтарда да тиімді нәтижесі көрінді.
Соңғы уақытқа дейін емделмей келетін аурулар, ең алдымен ми мен жұлынның жарақаттары емдеуіне клеткалық терапия технологиялары қолдануын белсенді түрде қарастырылуда.
Адамның NTERA–2 тератокарциномасы бар науқастың ЭДК алынған нейробластарды ауыстырып салу жолымен клеткалық терапия технологиясы ойдағыдай нәтижелі қолданылады. 50-100 млн. клеткалар көлемді биомасса алу үшін жетілмеген клеткаларды пассаж жасап көбейткен. Клеткалардың бір бөлігін фенотиптің сипаттамасын жасауға және қалдықтар пайызына, вирустар мен бактериялар ластануына тексерулер жүргізуіне қолданылды. Кейін ортадан LIF және стромалық фетальды клеткалардың фидерлі қабатын алып тастап нейрондарда ЭДК бағытты дифференциациясына жағдай жасалынды (фидерлі қабат ЭДК көбейюіне қажет, бірақ ол дифференциация процесіне кедергі жасайды). Кейін тератокарцинома клеткаларын толық алып тастау үшін нейробласт дақылын клеткалардың ағынды іріктеушіден өткізеді. Клеткаларды мұқият тексерістерден өткізген кейін, екіншілік тазартылған соң және фенотиптік сипаттамасы жасалған кейін трансплантация жасау үшін стереотаксис және компьютерлік томография бақылауымен арнайы микроканюля мен шприц арқылы 10-12 млн. нейробласттарды 6 ай бұрын геморрагиялық инсульт алған науқастың мийының базальды ядросына енгізді. Трансплантациядан кейін 12 ай бойы науқасты бақылауда инсульт болған аймақта нейрондардың кері нәтижесі тіркелген жоқ.. Пациенттердің жартысында 6-12 айлық трансплантациядан кейін моторлы симптомдардың дәлелді жақсаруы байқалған. Нәтижелі клиникалық симптомдары клеткалар трансплантациясынан кейін инсульт аймағында параллельді қанайналымы жақсарған.
Аутологиялық фибробластарды имплантациясы қолдануы өзіндік коллаген тіндерін өсіруін белсендіру үшін, әжімдер түскен аймағына, қартайып, салбырап, кеуіп келе жатқан тері аймақтарына активті дәнекер-тіндік клеткалар саның жоғарлату үшін ендіріліп келеді.
Дін клеткаларды енгізу тәсілдері
Дін клеткаларын пациенттің организміне стерильді жағдайда арнайы мамандырылған медицина қызметкері амбулатория жағдайында енгізеді (тамырға, бұлшықетке, теріасты немесе аппликация түрінде).
Дін клеткаларын трансплантациясында (басқа да трансплантация түріндегідей) донор мен реципиенттің сыйымдылығын анықтау үшін HLA-типтеу жүргізіледі, нәтижесінде шетінеу қауіпі минимумға жетеді – бұл серологиялық немесе молекулалық типтеу әдістері. Молекулалы-гендік типтеу үшін SSO (sequence specific oligonucleotides) және SSP (sequence specific primers) технологиялар жүргізіледі. SSO технологиясы ПТР кезеңдерінен кейін олигонуклеотидті зондылар көмегімен ампликондардың гибридизациясы жолымен детекция жүреді. SSP технологиясы аллель-спецификалық праймерлермен ПТР кезеңдері өтеді, кейін гель-электрофорез әдісімен детекциясы қолданылады.
Кіндік қан банкісінің негізгі міндеттері:
- ғылыми зерттеулер үшін кіндік/плацентарлы қанды дайындауын, тасымалдауын, қор жасауын ұйымдастыру;
- кіндік/плацентарлы қанды тестілеу және типтеу;
- адамның кіндік/плацентарлы қанынан дін клеткаларын бөліп алу;
- сұйық азотта адамның кіндік/плацентарлы қанынан алынған дін клеткаларын криогенді түрде сақтау;
- ғылыми зерттеулер жүргізу үшін ғылыми және білім беретін медицина мекемелеріне адамның кіндік/плацентарлы қанынан алынған дін клеткалар сынамаларын тағайындау;
- келісім шарт жасауымен жеке адамға адамның кіндік/плацентарлы қанынан алынған дін клеткалары сынамаларын рәсімдеу.
Мезенхималық дін клеткаларын сақтау
- иммунды жүйеге, гормонды, онкологиялық, алмасу және вирусты статусқа тестілеу үшін қан алу. 500 жуық параметрлер талқыланады;
- тіндерді алу: а) май қоспасы, 3-4 гр.; б) мықын сүйегін тесу арқылы сүйек кемігін алу, 20-60 мл.; в) тері, 3-4 мм. құлақ арты қыртысынан немесе басқа аймақтардан және т.б.;
- қаннан және тіндерден алынған дін клеткаларын дақылдандырады 8 млн/мл және арнайы бағдармалалы мұздатқышта минутына 0,5°С, 20°С-тан -70°С-қа дейін мұздатып қатырады, кейін қор үшін сүйық азотқа салып 1960С температурада шексіз уақытқа сақтайды.
Өзіндік дін клеткаларын сақтау жетістіктері
- клеткалар сүйық азотта 1960С температурада оңдаған жылдар бойы сақталынады; - әр сынама жоспар түрінде мүқиятты бактериологиялық және вирусологиялық бақылаудан өтеді;
- туған туысқандардың (ағасы, апасы, анасы, әкесі) иммунологиялық сыйымдылығы жоғары және қажетті болған жағдайда дін клеткаларының реципиенттері бола алады;
- кіндік қанынан клеткаларды, ең алдымен «дербес» (персоналды) клеткаларды жинау қаражаты оңдаған рет төмен, донордың дін клеткаларын іздеп табуымен салыстырғанда;
- клеткалық технологияны қолдану салалары кеңейіп келеді: медицина ғылымы дамуымен дін клеткалары алдын-ала жиналып қоры сақталуы көптеген аурулардың ауыстырылмайтын жаңа емдеу тәсілдерінің негізі.
Клеткалық терапияның мәселелері:
- белгілі жәйт емес, адам организмінде дін клеткалары дифференциация сатысына ауысуына қандай жағдайлар болатыны белгісіз; осы жағдайларды білу плюрипотентті клеткалардан нақты бағытты трансплантацияға қажеттісін алуға көмектеседі;
- бұл клетканың қызметіне, оның дифференциациясы мен пролиферациясына әсер ететін жаңа сигналдар мен жағдайлар тандау идентификация мәселелері. Мысалы, Н9 қатарда адамның ЭДК мезодерма, эктодерма, энтодерма дериваттарында клондардың өсуін тудыратын өсу факторлар комбинациясы табылған. Шынында, активин А + NGF-beta комбинациясы эндо- және эктодермаға клондар прогрессиясын тежейді, ал мезодермальды текті клондар пайда болуын шапшаң белсендіреді. Комбинация Ретиной қышқылы мен bFGF немесе BMP-4 мен EGF комбинациялары экто-, мезодерма клондарының селективті прогрессиясын белсендіре отыра энтодерма клондар дамуына тосқауыл қояды. Аяғында, HGF + NGF комбинациясы барлық ұрықтық жапырақтарының клондары өсуін актив-тендіреді;
- иммунологиялық шетінеу мәселесі бар. Себебі бластоцисталардан немесе ұрық тінінен алынған плюрипотентті клеткалар барлық уақытта реципиент клеткаларына ұқсас болмайды, сондықтан осындай айырмашылықты азайтып (минимум) сақтау керек немесе аллогенді тіндер банкін құру қажет.
Тіндік инженерия
Соңғы жылдары регенеративті медицина өздігімен ынталы дамып жатқан медицина пәніне айналды. 2006 жылдан бастап арнайы мамандырылған «Regenerative medicine» атты журнал шығады. Дін клеткалары көмегімен емдеу әдістерімен және келешектегі трансплантация үшін дін клеткаларды жинауымен және сақтауымен айналасатын дін клеткалар банкісімен (кіндік қаны банкі) шұғылданатын көптеген институттар мен компаниялар пайда болды. Регенеративті медицина, немесе тіндер инженериясы (tissue engineering) - бұл биология, медицина және инженерия тіркесінде қалыптасып келе жатқан мультипәндер аймағы, денсаулықты күшейтуді ағзалар мен тіндердің функцияларын қалпына келтіріп, тұрақты ұстап тұрып денсаулықты күшейту тәсілдерін түбінен өзгертеді.
Клеткалық терапия басталуында дайын клеткалар суспензиясының трансплантациясы қолданылды. Кейін клеткалық массаның көбейту технологиясы, тіндер дақылында in vitro-даоларды жинақтау технологиялары пайда болды. Әрі қарай тіндік құрылымдардың үш кеністікте дамуы және түрлі клеткалардың оның генерациясына қатысуын, ангиогенез бен сигналдық молекулаларды ескерілуі арқылы медициналық биотехнологияның мүлдем жаңа бағыты – тіндік инженерия дами бастады.
Соңғы оңжылдықта тіндер инженерияның дамуы келесі факторлардың қорытындылары нәтижесінен іске асты: геномика мен протеомика саласында білімді кеңейтуден; дін клеткаларына қол жеткізуден; тіндерді жалғау үшін потенциалды негіз ретінде жаңа биоматериалдардың пайда болуы; биореакторлар конструкцияларын жетілдіру және жараның жазылу процестері туралы білімді тереңдетуі – осының барлығы осы пәннің дамуына едәуір үлес қосты.
Тіндік инженерия технологиясы клеткалық биология мен материалтану жетістіктерін біріктіріп зертханалық жағдайда жартылай синтетикалық ағзалар мен тіндерді алуын қамтамасыз етеді. Бұл биологиялық технологияның өзіндік жеке саласы, молекулалық биология, биоинженерия принциптері мен әдістерін қолдану негізінде қалпына келтіруге, тұрақтандыруға және қызметін жақсарту үшін ағзалар мен тіндердің биологиялық алмастырушыларын құрастырады.
Тіндер инженерия мәнін оның мақсатынан іздеуге болады – жетіспей тұрған немесе зақымдалған ағзалар мен тіндерді қалпына келтіру үшін de novo жағдайында биосыйымды материалда клеткаларды дақылдандыру және трансплантациясын жасау; пациенттің жоғалтқан құрылымы мен оның функциясын қалпына келтіру үшін зертханада ex vivo-даағзалар мен тіндердің тірі функциональдық компоненттерін дайындау және конструкциясын жасау.
Тіндік инженерия ауто- және аллотрансплантаттарға қарасты альтернативалық стратегия ретінде қарастыруға болады, себебі оларды қолдануына табиғи шектеулері бар (мысалы, донорда асқыну дамуы, реципиентке жұқпалы аурулар жұқтыру және ажырап кетудің иммундық реакциялар даму қауіпі бар).
Тіндік инженерия технологиясы үш компоненттерді қолдануға негізделген: клеткалар көздері, сигналды молекулалар және каркас.
Клеткалар көздері: мезенхималық және эмбрионның дін клеткалары; аутологиялық, аллогенді және ксеногенді.
Сигнальды молекулалар: дін клеткалары дақылдануы және міндетті индукциясына нақты цитокиндер, өсу факторлары, аминқышқылдар, басқа да нәруыздар мен активті иондар қажет және мақсатты клеткалар мен тіндермен бірге өсірілуі тиісті. Клетканың клеткамен және клеткадан тыс матрикспен кеңістіктегі қарым-қатынасы адгезия молекулалары деп аталатын мембрана нәруыздарының бірнеше тұқымдастар мүшелерімен координацияланады. Олар конструкцияланатын ағзалар немесе тіндердің үшмерлі кеністіктік құрылымы жинақталуына, клеткаларға сигнал беруге, олардың өсуіне және дифференциациясына және иммунды танып алу мен қабыну процестеріне қатысуы аса маңызды болып саналынады.
Каркастар (матрикстер, қалыптар) саңылаулы, жайылып кететін құрылымдар, барлық табиғи материалдардан (мысалы, коллаген және фибриннен) немесе жасанды полимерлерден (полигликолид, полилактид немесе полилактидекогликолид) дайындалған. Жаңа технологиялар қолдануымен өнделген материалдардан дайындалған көптеген саңылау жүйесі мен каналдары бар губкалық пластиналар, гельдер немесе аса күрделі құрылымдар болып келеді. Тіндік инженерияда қолданатын барлық қалыптар имплантациядан кейін бәсендеп ыдырау керек және ақырында жаңа тінмен ауыстырылуы тиісті. Каркастар улы болмау керек, жақсы биосымдылығы бар, биоыдырағыш және арнайы типтегі клеткалармен өзгеше байланысуға қабілетті болуға тиісті.
Майлы тіннен МДК алу және қолдану технологиясы
Пациенттің теріасты-майлы клеткасынан липоаспирация әдісімен клеткалар суспензиясы алынды және арнайы қоректік орталарға себіліп олардан дін клеткалар ажыратылды. Нақты клеткалар типін бөліп алу үшін клеткалар сараптау әдісі, яғни флуоресцентті таңбаланған клеткаларды сараптау жиі қолданылады. Өсіп дамыған дін клеткаларын инфекцияға мүқият тексереді. Олардың морфологиялық және иммунологиялық сипаттамалары да тексеріледі. Айта кету керек, иммунды зерттеулер әдісі бойынша клетканың бетінде 25 нәруыздар – антигендер табылады. Майлы тіндерден бөлінген дін клеткалары келешек трансплантатты тасымалдайтын матрицаны (үшкеңістікті) тығыздап көлемді қаптайды, онда клеткалар қасиеттерін сақтайды. Тінге спецификасы бар клеткаларға дифференциациялайтын (мысалы, шеміршек клеткалары- хондроциттер), өсу факторлары бар қоректік ортадағы үшкеңістікті матрикс клеткаларды дақылдандырады. Қорытындысында пробиркада нақты тіннің үшкеңістікті бөлшектер қалыптасады. Сонымен, пациенттің өзіндік дін клеткаларынан қажетті тіннің үшкеңістікті трансплантаттар өсіруге болады.
Патологиялық өзгерген немесе бұзылған орнына жаңа тіндердің регенерациясы бар технология, ал организмнің осындай қабілеті жоқ. Ия, зақымданған адамдарда шектеулі жағдайда қалыпқа келуі мәлім (мысалы, сүйек сынықтары, тері жамылғының зақымдары), бірақ осындай сауығу болғанымен, жиі ол бейспецификалық «реконструктивті» тіндер (тыртық тіні) арқылы жүреді, тек зақымданған арнайы функциональды-активті тіндер арқылы емес.
Сонымен тіндік инженерияның мәні регенерация процесі басталып және тұрақты дамуына қабілетті клеткалар өсу факторлары немесе арнайы гендер көмегімен қатысуы, яғни қажетті типтегі жаңа функционалды тін қалыптасуы тиісті. Осы мақсат тіндер мен ағзалардың құрылымын дайындайтын матрикспен іске асады; жаңа тіннің геометриялық, архитектуралық формасы, кейін олар нақты пациенттің организміне ендірілетін болады. Каркастар құрылысы иесі-организмі тіні құрылымының көшірмесіне тен. Тіндер үш кеңістікте өсу үшін шаблонда көптеген саңылау торы (макросаңылау) болу керек. Саңылаулар бір-бірімен байланысты болу керек, ал олардың арасындағы тесіктер диаметрі 100 мкм астам. Бұл клеткалардың каркас бойынша жылжуына көмектеседі және бүкіл каркас бойында тіндер өсуіне қажет, осының бәрі саңылау торы ішінде ангиогенез дамуына ықпал жасайды. Каркасты материал иесі-организмі тіндеріне тыртық қалдырмай ену керек.
Тіршілік ететін тіндерді өндеу үшін in vitro-дабиоактивті ерітінді қалыптарда клеткаларды дақылдандырады, орта олардың дифференциациясына физикалық және химиялық белсенуіне және тіндердің үшкеңістік тіндерге жинақталуына жағдай жасайды.
Жаңа тін өсу барысында каркаста дақылданған тін жойылып кетеді (резорбция), яғни тек жаңа тін немесе жаңа тін мен каркастан құралған «биокомпозит» имплантацияланады. Іn vitro-да алынған тіндік конструкция имплантациядан кейін сіңіріліп, нормадағы функцияны, механикалық және құрылымды бүтіндікті қалпына келтіреді, және қоршаған тіндермен интеграциялануы тиісті.
Тіндік инженериямен бір пациенттен алынған клеткаларды қолдануы донордың трансплантатты қолдануда кездесетін иммундық ажырап кету мәселесін болдырмайды.
Ортопедияда сіңіріліп кететін каркастардан (полисүт қышқылдың, полигликолқышқылдың полиэфирлері және олардың қоспасы) басқа олардың беткейінде тіндердің өсуін белсендіретін (мысалы, биоактивті материал бетінде сүйектің өсуі) биоинертты (тот баспайтын болат, циркония тотығы, тығыздығы жоғары полиэтилен және т.б.) және биоактивті материалдар (бұл шынының биоактивті түрлері, жасанды гидроксиапатитті керамика және т.б.) қолданады. Биоыдыраушы полимерлер көбіне жұмсақ тіндер, байланыстарды қалпына әкелуге қолданылады, себебі осындай каркастардың механикалық қасиеттері төмен, сүйектермен салыстырғанда.
Тіндік инженерия технологиясында қолданатын биокомпозиттер ортопедияда қолданатын биоматериалдардан айырмашылығы бар. Ортопедиялық имплантаттарда тірі клеткадағы келесі сипаттамалары жоқ:
- өздігінен қалпына келу қабілеттілігі;
- қанайналымын ұстап тұру қабілеттілігі;
- қоршаған орта факторларына жауап ретінде, мысалы механикалық ұстемелерге өзінің құрылысы мен қасиетін өзгерту қабілеттілігі.
Инжинирингті тіндер (ex vivo дайындау):
- тері – терілік суррогатты материал, құрамында сиыр коллагенінен алынған мембрана және молекула аралық байланысы бар хондроитин-6-сульфат, полилоксанды алып-салмалы қабатпен қапталған. Осындай терілік суррогатты өнделген жара аймағына салады, жара жазылу сатысында және қантамырларды өсіру үшін беткейлік эпидермалы қабатты тері бөлігіне аутогенді трансплантат ретінде немесе дақылданған кератиноциттер түріндегі кесінділерді қолданады (бұл белгілі бір технология).
Тіршілікті терінің екі түрі нәрестенің жыныстық мүшесінің тәнінен алынған адамның тері фибробластары негізінде өнделген:
а) фибробласттарды дақылда көбейтіп полилактид-когликолид-полимерлі нәзік қалыпқа салады (алғашында хирургиялық тігін материалы ретінде қолдануға өнделген), кейін ол су бар жерде ыдырайды. Қалыптағы клеткаларды арнайы биореакторда бірнеше апталар бойы дақылдандырады, терінің дерма қабатына тән тіндер өнделгенге дейін өсіреді. Осы неодерманы келесі қолдануға дейін қатырып мұздатады;
б) терінің екінші өнімі дерма және эпидермалды қабатты құрайды. Олар дене температурасына дейін қыздырғанда гельге айналатын коллаген ерітіндісіндегі тері фибробластарынан құралған. Осы гель адамның эпидермалық клеткалардың бірнеше қабатымен қапталады (кератиноциттермен). Пациентке ендірген кейін осындай тері өнімі жазылу барысында иесі терісінің клеткаларымен жартылай ауыстырылады.
Тері фибробластары «жасанды» терінің бірінші және екінші типтеріде клеткадан тыс нәруыздарды бөледі және иесі клеткаларымен синтезделетін өсу факторларына әсер етеді. Өсы өнімдер иесі организміне имплантация жасағаннан кейін бірнеше айлар бойы сақталынады;
- шеміршек – буын шеміршегінің қанайналымы болмайды, сондықтан олар өздігінен қалыпка келмейді. Технологиясы келесіде: пациенттен хондроциттер алынады, оларды дақылдандырады да зақымданған буын беткейіне имплантациясын жасайды. Дегенмен, хондроциттердің дифференцирленген фенотипін дақылда тұрақтандыруы, иесі-организмінде шеміршек беткейіне оларды қондырып, сіңірілуі қиындықтар тудырады;
- ұйқы безі – in vitro-даЛангерганстың клеткаларын бөліп алу және өсіру, полимерлі каркастар көмегімен осы клеткаларды капсуламен қаптау немесе иммобилизациялау және тіндер инженерия көмегімен алынған конструктілерді трансплантациялау. Бірақ, ex vivo-да клеткалардың биологиялық активтілігін ұзақ уақыт ұстап тұру технологиясы қиын;
- бауыр – екі технологиясы зерттеледі: тікелей инъекция салып гепатоциттердің трансплантациясы жүреді, яғни in vivo-дағыклеткалық терапия және екіншісі, конструктты дайындау үшін сіңіріліп кететін каркаста гепатоциттерді ex vivo-даөсіру, оны имплантациялауға болады немесе in vitro-дақаннан зат алмасу өнімдерін алып тастау үшін соңғысын конструктыдан өткізеді;
- бүйрек – эндокринді функцияны атқаратын тінді бөліп алу, реабсорциясы. Экспериментті зерттеулер бастапқы сатысында: бүйректі дін клеткаларын имплантаттайтын қуыс микротүбектен матрикс алынды; түбектің ішкі қабатын толығымен қаптағанға дейін соңғыларын пролиферациялайды. Келешекте осы клеткалар кейбір гормондарды синтездейтін және қанның фильтрлеуіне қатысатын бүйрек клеткаларына дифференциациясы жүреді;
- жүрек-қантамырлар жүйесі – дін клеткалар көмегімен in vitro-да жүрек қақпақшалары мен капиллярларын бөліп алуы экспериментте зерттелінеді;
- «сүйекті аяқ» – сүйекті ауыстырып салғанда дін клеткалармен өнделген биокерамика қолданылады. Биокерамика табиғи сүйектің саңылаулы құрылымын имитациялайтын гидроксиапатиттен құралған. Бұл сүйек кемігінің стромалық дін клеткалары уақыт өте келе жаңа сүйек тінің қалыптастырады;
- қуық – осы қуысты ағзаны алу үшін аутологиялық тінге спецификасы бар дін клеткалары зерттелінеді (сурет 11.);
- көздің мүйізді қабаты – мүйізді қабаттың шетінен алынған дін клеткалары қолданылады. Бөлініп алынған клеткаларды арнайы қоректік ортада өсіреді, бір апта өткенде клетка тобы дамиды, ал 4 аптада диаметрі 2 см мүйізді қабат қалыптасады. Осы тәсілмен мүйізді қабатты сырттан қаптайтын конъюнктива тіні өсіріледі.

Сүрет11. Зертханада өсірілген қуық (www.moikompas.ru)
Тіндік инженерия технологиясының өзекті мәселелері
Регенеративті медицинаның жетістіктері көп жағдайда дін клеткалардың микроортасына тәуелді. Маңыздысы, дін клеткаларын табиғи ортасынан бөліп алған кейін, in vitro-да дақылдандырғанда және трансплантация жасағанда тіндер регенерациясына қабілетті болуы. Мысалы, сүйек кемігінде орналасып, in vivo, адамның МДК/МСК (human mesenchimal stem cells – hMSC) плюрипотенттілігін сақтайды, ал in vitro-да дақылдануында бірден микроортасын өзгерткенінен спонтанды түрде дифференциацияланады. Өсі факторлары, реттеуші биомолекулалар ролімен қоса МДК дифференциациясы процесіне матрикстің эластикалылығы да маңызды. Мысалы, нерв тіндерінің клеткадан тыс матриксінің механикалық қасиеттеріне ұқсас жұмсақ матриксттер нейрогенді қорытынды береді; сәл тығыздылары – миогенді әсері бар; ал сүйек тініне ұқсас тығыз матриксттер МДК остеоциттерге дифференциациялауын белсендіреді. Клеткалардың морфологиялық өзгеруіне және олардың бағытты дифференциациясына матрикстің физикалық қасиеттерінің әсері макромолекулалы актинді құрылымдар – бұл 100 жуық түрлі нәруыздар арқылы жүреді.
Тіндердің инжинирингі арқылы дайындалған көптеген конструкциялар екі кеністіктегі конфигурацияда көбейтілген бір немесе екі типті клеткалардан құралған. Сондықтан клеткаларды бөліп алуын, көбейтуін және дифференциациясын жетілдіру қажет, ex vivo-да тіндердің үш кеністікте өсуін қалыптастыру және координациялау үшін каркасы немесе тасымалдау жүйесі конструкциясын өндеу керек.
In vitro-да өздік қанайналымы жоқ тіндер көлеміне қойылатын негізгі шектеулердің бірі сіңіргенге дейінгі тін бойына оттегі таралуын қамтамасыз ететін жолдың қысқа болуы (ең көлемдісі – бірнеше жүз микрометр). Белгілі, әр бір тін арнайы клеткалары мен қоса қантамырлық, нервтік және фибробластар кездеседі, капиллярлар, нерв талшықтары және дәнекер тіндері орналасады. Сондықтан, өзекті мәселенің бірі еx vivo-да бір мезгілде тіннің барлық компоненттері жаңаруы маңызды, яғни өсу факторларын, әсіресе қантамырлық эндотелий клеткаларды өсіретін фактор (EGF), фибробластардың өсіру факторы (FGF) және т.б. жәймендеп бөліп отыратын технологиялар қарастыру керек.
Идеальды стратегияның бірі пациенттен дін клеткаларын бөліп алу, әрі қарай оларды клетка дақылдарында өсіру және каркасқа қондыру. Егер дін клеткаларына нақты биологиялық белсендіргіш заттармен, сигналды молекулалармен әсер еткенде көптеген типтегі мамандырылған жетілген клеткалар пайда болады. Нақты пациентке «өзіндік» ағзалар пайда болуына сынақтар жүргізіп келешекте донор ағзасына сұранысты алып тастауға келешектегі технологиялар жұмыс атқаруда.
Жаңа дәрілерді тестілеу
Трансплантологияда дін клеткаларынан дамыған ағзаларды (мысалы, бауыр тіндері) жаңа дәрілерді сынауға қолдануға болады. Осындай мақсатқа зертхана жануарлары қажет, сирек, эксперименттер in vitro-даорындалады. Дәрілерді тексеруінің жаңа әдісі біріншіден, жануарларға қойылатын гуманды емес сынақтарды шектеу, екіншіден, әдіс жылдам және нақты қорытынды алуға бағытталған.
3. Биосенсорлар мен биочиптер 
Дата добавления: 2015-07-14; просмотров: 2787;
