Селективность.
Этот критерий используют для оценки эффективности осуществления сложных химических реакций, когда наряду с целевой протекает побочная реакция, т.е. используется в случае сложных химических реакций.
aA+bB→rR+sS
a1A+b1B→pP+sS
Экскурс:
Классификация реакций:
- простые
- сложные
В основе лежит признак: сколько раз преодолевается энергетический барьер при осуществлении химической реакции.
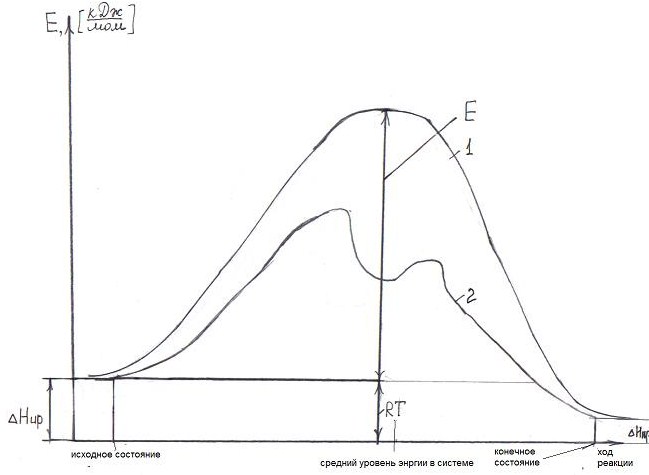
Рис.3.1 К понятию энергетического барьера.
RT=8,31∙(272+420)≈5760 кДж/кмоль=5,760 кДж/моль
Характеризует энергию внутренней системы в начальный момент и в конце процесса.
Из закона Гесса:

∆Н и.р.- энергия исходных реагентов
Средний уровень энергии молекул в системе.
Энергия активации (Е) – это такой минимальный избыток энергии над средним уровнем энергии молекул системы необходимый для осуществления химической реакции.
Е=(40÷60)кДж/моль
Простые реакции:
- это такие реакции, когда энергетический барьер преодолевается 1 раз (слева → направо), в основном необратимые реакции(реакции горения).
CH4+2O2→CO2+2H2O
Сложные реакции:
- это такие реакции, когда энергетический барьер преодолевается несколько раз.
Например: обратимые реакции:

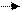 N2 + 3H2 2NH3 (1.1)
N2 + 3H2 2NH3 (1.1)
A→R→S
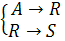 (3.2)
(3.2)

Первая стадия получения азотной кислоты.
Дата добавления: 2015-08-21; просмотров: 519;
