Энергетические уровни атомов
Энергия электрона, находящегося на стационарной орбите, называется уровнем энергии атома (энергетическим уровнем). С увеличением квантового числа энергия атома возрастает и при n®¥ , E®0.
Рисунок 29.
 |
Уровни значений полной энергии атома водорода представлены на рис.29.
С возрастанием квантового числа увеличивается расстояние (радиус орбиты, по которой движется электрон), а полная и потенциальная энергия стремится к нулю. Кинетическая энергия также стремится к нулю и область E>0 соответствует состоянию свободного электрона.
Кроме главного квантового числа n= 1,2,3… состояние атома характеризуется орбитальным ℓ=0,1,2,… n-1, определяющим форму орбиты, магнитным m1 = -1,…,-1,0,+1,…,+1 (ориентация орбиты в пространстве), магнитным спиновым ms= -1/2; +1/2 (собственное вращение электрона в атоме). То есть для одинакового главного квантового числа существует множество состояний электрона (энергетических состояний), распределение, которых удовлетворяет двум принципам:
1. В атоме состояние всех электронов различны, то есть не может быть электронов, имеющих одинаковую комбинацию квантовых чисел (принцип исключения) - установлен в 1925 году швейцарским физиком В.Паули].
2. Распределение электронов в атоме должно соответствовать минимуму энергии атома (принцип минимума энергии).
Общее число электронов в атоме определяется зарядом его ядра, выраженным через элементарный заряд. У атома с минимальной энергией (невозбужденного) электроны заполняют ближайшие к ядру слои, имеющим n оболочек (от 0 до n-1) с определенным количеством электронов в каждой из них.
Построение этой теории стало возможным благодаря тщательным исследованиям спектров излучения различных газов (спектров излучения атомов), в результате которых были обнаружены спектральные линии, расположенные по определенной закономерности. В атоме водорода, например, эта закономерность определена формулой Бальмера-Ридберга
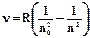 ,
,
где R = me2/8ε2h2 = 3,28985·1015 с-1 ≈ 3,29·1015 c-1 – постоянная Ридберга, n и n0 – квантовые числа, соответствующие начальному (до излучения) и конечному (после излучения) энергетическим состояниям атома.
При переходе электрона с одной стационарной орбиты на другую (ближнюю к ядру) атом излучает квант энергии, равный разности энергий атома до и после излучения
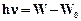 .
.
В спектре можно выделить группы линий, которые получили название спектральных серий. Каждая серия соответствует переходам возбужденного атома на один и тот же энергетический уровень (рис.30)
Серия Лаймана расположена в ультрафиолетовой части спектра. Она образуется в результате перехода электронов с верхних энергетических уровней на основной (n=1). Интенсивность возрастает с уменьшением длины волны.
Серия Бальмера находится в видимой и близкой к ультрафиолетовой областях спектра. Она обнаружена в 1885 году швейцарским физиком Бальмером и является, по сути, началом построения квантовой теории атома.
Серия Пашена находится в инфракрасной области спектра. Она возникает при переходе электронов на третий энергетический уровень.
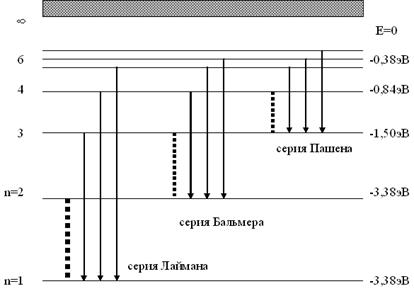
Рисунок 30.
Существуют и другие серии, однако спектр ограничен, так как энергетические уровни атома по мере увеличения главного квантового числа сближаются и вероятность перехода между ними мала, поэтому они практически не наблюдаются.
Дата добавления: 2015-06-22; просмотров: 1664;
