Кинетика и механизм процесса
Термические реакции углеводородов могут протекать как молекулярные, так и радикальные цепные или нецепные. Ионные реакции в условиях термических процессов не протекают, так как гетеролитический распад С—С-связи требует энергии 1206 кДж/моль, значительно большей, чем гомолитический, — 360 кДж/моль.
В настоящее время наиболее принят радикально-цепной механизм крекинга. Большое значение в создании основ современной кинетики гомогенных газовых реакций имела разработанная академиком Семеновым общая теория цепных реакций.
Радикально-цепной процесс термического разложения, как любой цепной процесс, складывается из трех стадий: инициирование цепи; продолжение цепи; обрыв цепи.
Инициирование цепи. Распад углеводородов на радикалы (инициирование цепи) осуществляется преимущественно по связи С—С. Разрыва С—Н-связи не происходит, так как для этого требуется значительно больше энергии: энергия С—С-связи 360 кДж/моль; энергия С—Н-связи 412 кДж/моль.
В нормальных алканах с длинной цепью энергия разрыва С—С и С—Н-связей несколько уменьшается к середине цепи, однако первая всегда остается значительно меньше второй:
CH3–CH2–CH2–CH2–CH2–CH2–CH2–CH3
Энергия связи С—С, кДж/моль: 335; 322; 314; 310; 314; 322; 335
Энергия связи С—Н, кДж/моль: 394; 373; 364; 360; 360; 364; 373; 394
С повышением температуры различие в прочности связей С—С уменьшается. При умеренной температуре (400–500°С) разрыв углеводородной цепи происходит посередине, по наиболее слабым связям. С повышением температуры может происходить разрыв и других связей.
Связи С—С в циклоалканах несколько менее прочны, чем в нормальных алканах: в циклогексане — на 8 кДж/моль, в циклопентане — на 25 кДж/моль.
Связи С—С и С—Н в алкенах у атома углерода с двойной связью значительно прочнее, а в 5-положении — сильно ослаблены по сравнению с алканами (цифры означают энергию связи в кДж/моль):
H H
375 | | 321
R – CH2 – CH2 – C – C – CH = CH2
334 |259| 371
H H
Энергия раскрытия π-связи в алкене при сохранений σ-связи равна 239 кДж/моль:
• •
СН2=СН2 ® СН2СН2 — 239 кДж/моль
Если двойная связь является сопряженной, то энергия раскрытия π-связи примерно на 50 кДж/моль меньше:
• •
СН2=СН—СН=СН2 ® СН2=СН— СН—СН2 — 188 кДж/моль
В аренах связи С—Н и С—С прочнее, чем связи С—Н и С—С в алканах, а связи, сопряженные с ароматическим кольцом, ослаблены. Сопряжение с кольцом понижает прочность связи примерно в той же мере, как и сопряжение с двойной связью.
Реакции радикалов. Радикалы, являясь химически ненасыщенными частицами, обладают высокой реакционной способностью и вступают в различные реакции с очень большой скоростью. По активности радикалы можно расположить в ряд:
. . . . . . . .
C2H3>CH3=C3H7=втор-C4H9>C6H5 >C2H5>трет-C4H9>C6H5CH2>CH2=CHCH2>
.
(C6H5)2CH.
Различают следующие реакции радикалов:
1) моно- и бимолекулярную диссоциацию молекул на два свободных радикала (инициирование цепи)
• •
С2Н6 ® СН3 + СН3
•
C2H6 + C2H4 ® 2С2Н5
2) замещение
• •
CH3 + C2H6 ® CH4 + C2H5
3) распад радикалов с образованием ненасыщенных молекул
и новых свободных радикалов; распад протекает преимуществен-
но по β-связи по отношению к атому углерода с неспаренным
электроном (β -правило)
• •
СН3СН2СНСН3 —> СН2=СНСН3 + СН3
4) присоединение радикалов по кратной связи (реакция, обратная предыдущей)
• •
СН3 + С2Н4 ® С3Н7
5) изомеризация свободных радикалов. Предполагают, что
изомеризация протекает через циклическое переходное состояние
•
•
CH2CH2CH2CH2CH2CH2CH3 « 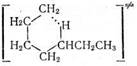 «CH3CH2CH2CH2CH2CHCH3
«CH3CH2CH2CH2CH2CHCH3
Легче образуются 6-членные циклы, труднее 5- и 7-членные, 3- и 4-членные циклы слишком напряжены, поэтому 1,2- и 1,3-изомеризация алкильных радикалов практически неосуществима.
Обрыв цепи. Осуществляется следующими реакциями:
6) рекомбинацией радикалов
• •
СН3 + СН3 ® С2Н6
7) диспропорционированием
• •
СН3 + С2Н5 ® СН4 + С2Н4
Как уже было отмечено выше, энергия активации реакции 1) —инициирования цепи — определяется энергией связи С—С в углеводороде. β-распад крупных радикалов (С3 и выше) — реакция 3) — протекает с энергией активации 110–170 кДж/моль. Взаимодействие относительно устойчивых метальных и этильных радикалов и атомов водорода с исходными молекулами-реакция 2) — требует энергии активации всего 25–37 кДж/моль. Энергия активации реакций обрыва цепи — рекомбинации 6) и диспропорционирования 7) — равна 0. Энергия активации суммарной цепной реакции для бутана составляет 245 кДж/моль.
Реакции термического разложения обычно описываются уравнениями первого порядка. Однако четкое математическое описание всего комплекса термических реакций не представляется пока возможным ввиду того, что крекинг и пиролиз даже простейших углеводородов включает множество элементарных актов. Кроме того, на кинетику цепной реакции крекинга оказывают влияние продукты реакции.
Дата добавления: 2015-06-12; просмотров: 1838;
