АНТИТЕЛА
При электрофорезе сыворотки крови белки разделяются на две фракции: альбумины и глобулины, в свою очередь последние - на альфа, бета и гамма фракции.
Совокупность сывороточных белков, обладающих преимущественно гамма - электрофоретической подвижностью и проявляющих активность антител, называется иммуноглобулинами.
Содержание глобулинов в сыворотке крови составляет в среднем 35-45 %, гамма-фракции – 12-18%.
Антитела– это иммуноглобулины, способные специфически соединяться с антигеном.
Кроме антител к иммуноглобулинам относят: иммуноглобулиновые рецепторы лимфоцитов, молекулы ГКГС 1 и 2 классов, адгезивные белки, а также белки, сходные с антителами по химической структуре и антигенной специфичности - миеломные белки, белки Бенс - Джонса и субъединицы Ig.
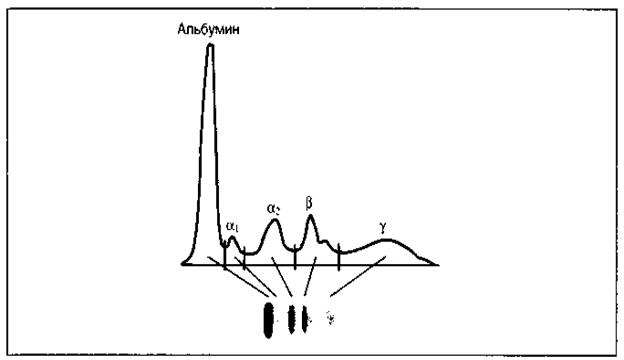
Рис. 8. Зональный электрофорез нормальной сыворотки. На электрофореграмме и денситограмме нормальной сыворотки видны пять основных полос, которые соответствуют альбумину, α1, α2, β- и γ – глобулинам
Биологические функции антител - направлены на элиминацию чужеродного антигена из организма. Антитела:
Ø распознают и связывают антиген;
Ø представляют его мф и лф;
Ø оказывают цитотоксическое действие в отношении чужеродных клеток
Ø опсонирующее влияние;
Ø активирует систему комплемента.
Для понимания биологического действия антител необходимо различать следующие понятия:
· специфичность антител - способность Ig реагировать только с оп-ределенными антигеном.
· валентность - это количество антидетерминант (паратопов) в молекуле антитела; как правило они бивалентны, хотя существуют 5- и 10-валентные антитела.
· аффинность- прочность связи между детерминантами антигена и антидерминантами антитела (эпитопа и паратопа).
· авидность характеризует прочность связи антигена с антителом в реакции антиген-антитело (определяется аффинностью и валентностью антигена).
Общий план строения иммуноглобулинов:
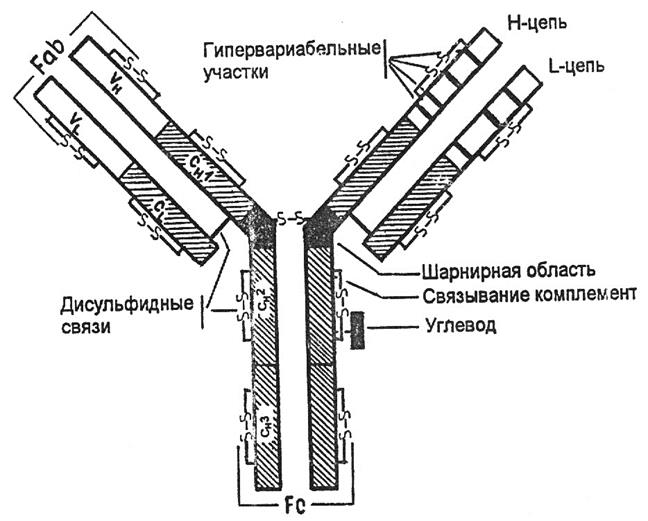
На примере иммуноглобулина G можно видеть, что молекула Ig содержит 2 тяжелые и 2 легкие цепи, которые соединены дисульфидными связями. Каждая цепь содержит вариабельную и константную область, составляющие Fab (антигенсвязывающий фрагмент) и Fc- константный фрагмент. Гомологичные структурные участки легких и тяжелых цепей иммуноглобулинов, образуемые дисульфидными связями, называются доменами. Домены имеют одинаковые последовательности аминокислот. Каждый домен включает приблизительно 100-110 аминокислотных остатков.
Различают домены константных участков:
Сl, СН1, СН2, СН3.
Сl, СН1 домены – обеспечивают нековалентное связывание легких и тяжелых цепей и аллоантигенные различия антител.
СН2 – место присоединения углеводов и связывания комплемента.
СН3 – участок взаимодействует с Fc –рецептором на поверхности клеток, принимающих участие в иммунных реакциях.
При взаимодействии вариабельных Vl и Vh-доменов формируется антигенсвязывающий участок ат (активный центр). Изменения последовательности аминокислотных остатков этих доменов от белка к белку определяют меняющуюся специфичность антител.
Между СН1 и СН2 доменами находится шарнирная область, обеспечивающая подвижность Fab-фрагмента.
Рис. 9. Строение иммуноглобулина G
В основе реакции антиген – антитело лежит взаимодействие между эпитопами антигена и паратопами антитела, основанное на их пространственном соответствии (комплементарности).
Эти связи обусловлены следующими типами межмолекулярных сил:
· Электростатическими (ионными, полярными)
· Водородными
· Гидрофобными
· Силами Ван – дер – Вальса
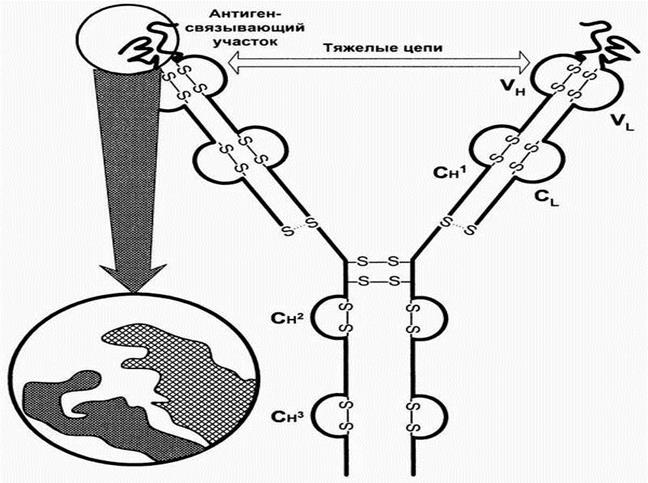
Рис. 10. Гетерогенность иммуноглобулинов.
Принадлежность иммуноглобулина к тому или иному классу или подклассу зависит от характерных особенностей строения тяжелых цепей (количества и последовательности аминокислотных остатков, молекулярной массы, количества доменов и др.). Тяжелые цепи бывают 5 типов (α, γ, δ, ε, µ). Легкие – только двух разновидностей – каппа и лямбда. Тяжелые цепи независимо от принадлежности к тому или иному классу или подклассу образуют комплекс либо с каппа, либо с лямбда типом. В зависимости от строения константных областей тяжелых цепей (Fc) иммуноглобулины разделены на 5 классов (IgA, IgM, IgG, IgD, IgE).
Дата добавления: 2015-06-05; просмотров: 1439;
