Кислотність грунтів, її форми
Реакція грунту проявляється при взаємодії його з водою або розчинами солей. Вона визначається співвідношенням водневих і гідроксильних іонів у грунтовому розчині і характеризується показником рН. рН = -lg [H+]. Якщо рН=7, то реакція нейтральна, при рН більше 7 – лужна, менше – кисла. В грунтах рН коливається в межах від 3,5 (верхові торф'яники) до 8-9 (солончаки і солонці). Оптимальний рН (близько 7) характерний для некарбонатних грунтів, ГПК яких повністю насичений Са та Mg.
Виділяють актуальну (активну) і потенційну кислотність грунту залежно від того, при якій взаємодії вона проявляється і вимірюється.
Актуальна кислотність грунту зумовлена наявністю іонів водню у грунтовому розчині. Залежить від наявності в грунтовому розчині вільних кислот, гідролітично кислих солей, ступеня їх дисоціації. Актуальна кислотність грунту вимірюється при взаємодії грунту з дистильованою водою (водний рН, рН(Н2О)), при розведенні 1:2,5 або у пасті. Деколи рН грунту визначається за допомогою електрода безпосередньо у грунті за природних умов. Потенційна кислотність – здатність грунту при взаємодії з розчинами солей вести себе як слабка кислота. Визначається вона властивостями твердої фази грунту, яка зумовлює появу додаткових водневих іонів у розчині при взаємодії з добривами або хімікатами. Характеризує сумарну концентрацію кислот і кислотних агентів, що існують у даному грунті як у дисоційованому, так і не дисоційованому стані. Природа потенційної кислотності складна, носієм її є обмінні катіони водню й алюмінію в ГПК:

В органічних горизонтах головну роль у формуванні кислотності відіграє обмінний водень, причому безпосереднім джерелом його служать органічні кислоти, включаючи гумусові, і вугільна кислота. При взаємодії з колоїдами водень цих кислот входить в їх дифузний шар, займаючи місце основ, які вилуговуються чи випадають в осад. Кислотність мінеральних колоїдів зв'язана з наявністю у ГПК обмінних іонів водню, алюмінію і заліза. Джерелом алюмінію і заліза є іони водню кристалічної решітки глинистих мінералів і гідроксидів.
Залежно від характеру взаємодії грунту з розчинами розрізняють дві форми потенційної кислотності грунтів: обмінну і гідролітичну.
Обмінна кислотність виявляється при взаємодії з грунтом розчинів нейтральних солей. Використовують звичайно 1н розчин КСІ (рН=5,6). При взаємодії кислого грунту з розчином хлориду калію в результаті обміну калію на водень в розчині появляється соляна кислота, а при обміні на алюміній – хлорид алюмінію, який при гідролізі утворює сильну кислоту:
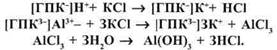
При рН грунту менше 4 кислотність зумовлена в основному обмінним воднем, при рН від 4,0 до 5,5 – обмінним алюмінієм. Виражається в мг-екв/100 г грунту або рН сольовим (КС1). За величиною рНсол. грунти поділяються на: сильнокислі (<4,5), кислі (4,6-5,0), слабокислі (5,1-5,5), близькі до нейтральних (5,6-6,0), нейтральні (6,1-7,0). Для слаболужних і лужних грунтів (рН > 7,0) рН сол. не визначають.
Гідролітична кислотність виявляється при взаємодії грунту з розчинами гідролітично лужних солей (сильного лугу і слабкої кислоти). Звичайно використовують 1 н розчин СН COONa, pH якого 8,2:
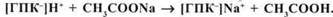
Кількість оцтової кислоти, яка утворилася, визначають титруванням. Вона і характеризує гідролітичну кислотність грунту. Гідролітична кислотність звичайно більша, ніж обмінна. Виражається в мг-екв на 100 г грунту.
Наявність потенційної кислотності характерна для грунтів, збіднених лужноземельними металами (Са2+, Mg2+). Чим більше грунт збіднений основами, тим значніше виявляє він кислотні властивості.
Велике значення в утворенні визначеної реакції у грунті має характер грунтоутворюючої породи. Підзолисті грунти, бідні основами, сформувалися на вилугуваних безкарбонатних породах. Ґрунтоутворюючий процес також впливає на втрати основ і підкислення (підзолистий процес), у інших випадках спостерігається збагачення грунту основами (дерновий процес). На формування кислих грунтів мають вплив кліматичні умови (промивний характер водного режиму), рослинність (хвойні ліси, трав'яниста рослинність, листяні ліси) також впливає на формування грунтів з різною реакцією.
Сільськогосподарська діяльність людини викликає зміну реакції грунту: виніс елементів живлення з урожаєм, довготривалий обробіток, внесення мінеральних добрив, хімічна меліорація грунтів.
Частина обмінних катіонів водню і алюмінію в грунтовому поглинальному комплексі, визначена як обмінна або гідролітична кислотність, характеризує ненасиченість грунтів основами.
Ступінь насиченості грунтів основами – це кількість обмінних основ (зазвичай Ca2++Mg2+), виражена у відсотках до ємності поглинання (див. 6.4). Звідси, знаючи величину суми ввібраних основ та гідролітичну кислотність, додавши їх, можна розрахувати величину ємності поглинання. Отже, ненасиченість грунтів основами характеризується різницею між ємністю поглинання при вибраному значенні рН і вмістом у грунті обмінних основ.
Постає запитання, а чи можливий в природі випадок, коли величина ємності поглинання та суми ввібраних основ збігатимуться? Звичайно, але тільки у лужних грунтах, в яких ГПК абсолютно насичений основами. В таких умовах СНО=100%.
Основним методом підвищення продуктивності кислих грунтів є зниження їх кислотності вапнуванням. Теоретичною базою вапнування є вчення К.К.Гедройца про грунтовий поглинальний комплекс. Виходячи з цього, при внесенні вапна (СаСО3) проходить взаємодія його з кислим грунтом за схемою (СаСО3 при наявності надлишку вуглекислоти переходить у розчинний Са(НСО3)2):
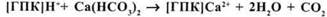
Грунти з високим ступенем насиченості не потребують вапнування. Звичайно доза вапна розраховується по гідролітичній кислотності орного шару грунту.
Вапнування сильнокислих грунтів створює сприятливі умови для розвитку мікроорганізмів-азотфіксаторів, нітрифікаторів, фосформобілізуючих мікроорганізмів. У таких умовах зростає активність нейтральних фосфатаз.
Вапно не відноситься до добрив, але вапнування підвищує ефективність внесених мінеральних добрив. Урожайність та біопродуктивність рослин на вапнованих і удобрених полях значно вища, ніж на удобрених, але не вапнованих.
Дата добавления: 2015-05-28; просмотров: 1461;
