Микрососудов и фагоцитоз; они обладают бактерицидным
действием, вызывают вторичную альтерацию (гистолиз), включают иммунные механизмы в воспалительную реакцию, регулируют пролиферацию и дифференцировку клеток на поле воспаления, направленные на репарацию, возмещение или замещение очага повреждения соединительной тканью (схема XI). Дирижером клеточных взаимодействий на поле воспаления является макрофаг.
Медиаторы плазменного и клеточного происхождения взаимосвязаны и работают по принципу аутокаталитической реакции с обратной связью и взаимной поддержкой (см. схемы X и XI).
Действие медиаторов опосредовано рецепторами на поверхности эффекторных клеток. Из этого следует, что смена одних медиаторов другими во времени обусловливает смену клеточных форм на поле воспаления - от полиморфно-ядерного лейкоцита для фагоцитоза до фибробласта, активируемого монокинами макрофага, для репарации.
Экссудация- фаза, быстро следующая за альтерацией и выбросом медиаторов. Она складывается из ряда стадий: реакция микроциркуляторного русла с нарушениями реологических свойств крови; повышение сосудистой проницаемости на уровне микроциркуляторного русла; экссудация составных частей плазмы крови; эмиграция клеток крови; фагоцитоз; образование экссудата и воспалительного клеточного инфильтрата.
Схема XI.Действие медиаторов воспаления клеточного (тканевого) происхожде- ния
 Реакция микроциркуляторного русла с нарушениями реологических свойств крови - один из ярких морфологических признаков воспаления. Изменения микрососудов начинаются с рефлекторного спазма, уменьшения просвета артериол и прекапилляров, которое быстро сменяется расширением всей сосудистой сети зоны воспаления и прежде всего посткапилляров и венул. Воспалительная гиперемия обусловливает повышение температуры (calor) и покраснение (rubor) воспаленного участка. При начальном спазме ток
Реакция микроциркуляторного русла с нарушениями реологических свойств крови - один из ярких морфологических признаков воспаления. Изменения микрососудов начинаются с рефлекторного спазма, уменьшения просвета артериол и прекапилляров, которое быстро сменяется расширением всей сосудистой сети зоны воспаления и прежде всего посткапилляров и венул. Воспалительная гиперемия обусловливает повышение температуры (calor) и покраснение (rubor) воспаленного участка. При начальном спазме ток
крови в артериолах становится ускоренным, а затем замедленным. В лимфатических сосудах, как и в кровеносных, вначале происходит ускорение лимфотока, а затем его замедление.
Лимфатические сосуды переполняются лимфой и лейкоцитами.
В бессосудистых тканях (роговица, клапаны сердца) в начале воспаления преобладают явления альтерации, а затем происходит врастание сосудов из соседних областей (это происходит очень быстро) и включение их в воспалительную реакцию.
Изменения реологических свойств крови состоят в том, что в расширенных венулах и посткапиллярах при замедленном токе крови нарушается распределение в кровяном потоке лейкоцитов и эритроцитов. Полиморфно-ядерные лейкоциты (нейтрофилы) выходят из осевого тока, собираются в краевой зоне и располагаются вдоль стенки сосуда. Крае-
вое расположение нейтрофилов сменяется их краевым стоянием, которое предшествует эмиграции за пределы сосуда.
Изменения гемодинамики и сосудистого тонуса в очаге воспаления приводят к стазу в посткапиллярах и венулах, который сменяется тромбозом. Те же изменения возникают и в лимфатических сосудах. Таким образом, при продолжающемся притоке крови в очаг воспаления отток ее, а также лимфы нарушается. Блокада отводящих кровеносных и
лимфатических сосудов позволяет очагу воспаления выполнять роль барьера, предупреждающего генерализацию процесса.
Повышение сосудистой проницаемости на уровне микроциркуляторного русла является одним из существенных признаков воспаления. Вся гамма тканевых изменений, своеобразие форм воспаления в значительной мере определяются состоянием сосудистой проницаемости, глубиной ее повреждения. Большая роль в осуществлении повышенной проницаемости сосудов микроциркуляторного русла принадлежит поврежденным ультраструктурам клеток, что приводит к усилению микропиноцитоза. С повышенной сосудистой проницаемостью связаны экссудация в ткани и полости жидких частей плазмы, эмиграция клеток крови, образование экссудата (воспалительного выпота)
и воспалительного клеточного инфильтрата.
Экссудация составных частей плазмы крови рассматривается как проявление сосудистой реакции, развивающейся в пределах микроциркуляторного русла. Она выражается в выходе за пределы сосуда жидких составных частей крови: воды, белков, электролитов.
Эмиграция клеток крови, т.е. выход их из тока крови через стенку сосудов, осуществляется с помощью хемотаксических медиаторов (см. схему X). Как уже было сказано, эмиграции предшествует краевое стояние нейтрофилов. Они прилипают к стенке сосуда (главным образом в посткапиллярах и венулах), затем образуют отростки (псевдоподии), которые проникают между эндотелиальными клетками - межэндотелиальная эмиграция (рис. 63).
Базальную мембрану нейтрофилы преодолевают, вероятнее всего, на основе феноменатиксотропии (тиксотропия - изометрическое обратимое уменьшение вязкости коллоидов), т.е. перехода геля мембраны в золь при прикосновении клетки к мембране. В околососудистой ткани нейтрофилы продолжают свое движение с помощью псевдоподий. Процесс эмиграции лейкоцитов носит название лейкодиапедеза, а эритроцитов - эритродиапедеза.
Фагоцитоз (от греч. phagos - пожирать и kytos - вместилище) - поглощение и переваривание клетками (фагоцитами) различных тел как живой (бактерии), так и неживой (инородные тела) природы. Фагоцитами могут быть разнообразные клетки, но при воспалении наибольшее значение приобретают нейтрофилы и макрофаги.
Фагоцитоз обеспечивается рядом биохимических реакций. При фагоцитозе уменьшается содержание гликогена в цитоплазме фагоцита, что связано с усиленным анаэробным гликогенолизом, необходимым для выработки энергии для фагоцитоза; вещества, блокирующие гликогенолиз, подавляют и фагоцитоз.
 63.Эмиграция лейкоцитов через стенку сосуда при воспалении:
63.Эмиграция лейкоцитов через стенку сосуда при воспалении:
Рис.
а - один из нейтрофилов (H1) тесно прилежит к эндотелию (Эн), другой (Н2) имеет хорошо очерченное ядро (Я) и пронизывает эндотелий (Эн). Большая половина этого лейкоцита расположена в подэндотелиальном слое. На эндотелии в этом участке видны псевдоподии третьего лейкоцита (Н3); Пр - просвет сосуда. х9000; б - нейтрофилы (СЛ) с хорошо контурированными ядрами (Я) расположены между эндотелием и базальной мембраной (БМ); стыки эндотелиальных клеток (СЭК) и коллагеновые волокна (КлВ) за базальной мембраной. х20 000 (по Флори и Грант)
Фагоцитирующий объект (бактерия), окруженный инвагинированной цитомембраной (фагоцитоз - потеря цитомембраны фагоцита), образует фагосому. При слиянии ее с лизосомой возникает фаголизосома(вторичная лизосома), в которой с помощью гидролитических ферментов осуществляется внутриклеточное переваривание - завершенный фагоцитоз (рис. 64). В завершенном фагоцитозе большую роль играют антибактериальные катионные белки лизосом нейтрофилов; они убивают микробы, которые затем перевариваются. В тех случаях, когда микроорганизмы не перевариваются фагоцитами, чаще макрофагами и размножаются в их цитоплазме, говорят о незавершенном
фагоцитозе, или эндоцитобиозе. Его
|
 Электронограмма. х20 000.
Электронограмма. х20 000.
Рис. 64.Фагоцитоз. ыми включениями (Л).
объясняют многими причинами, в частности тем, что лизосомы макрофагов могут содержать недостаточное количество антибактериальных катионных белков или вообще лишены их.
Таким образом, фагоцитоз не всегда является защитной реакцией организма и иногда создает предпосылки для диссеминации микробов.
Образование экссудата и воспалительного клеточного инфильтрата завершает описанные выше процессы экссудации. Выпот жидких частей крови, эмиграция лейкоцитов, диапедез эритроцитов ведут к появлению в пораженных тканях или полостях тела воспалительной жидкости - экссудата. Накопление экссудата в ткани ведет к увеличению ее объема (tumor), сдавлению нервных окончаний и появлению боли (dolor), возникновение которой при воспалении связывают и с воздействием медиаторов (брадикинин), к нарушению функции ткани или органа (functio laesa).
Обычно экссудат содержит более 2% белков. В зависимости от степени проницаемости стенки сосуда, в ткань могут проникать разные белки. При небольшом повышении проницаемости сосудистого барьера через него проникают в основном альбумины и глобулины, а при высокой степени проницаемости наряду с ними выходят и крупномолекулярные белки, в частности фибриноген. В одних случаях в экссудате преобладают нейтрофилы, в других - лимфоциты, моноциты и гистиоциты, в третьих - эритроциты.
При скоплении в тканях клеток экссудата, а не жидкой его части говорят о воспалительном клеточном инфильтрате, в котором могут преобладать как гематогенные, так и гистиогенные элементы.
Пролиферация(размножение) клеток является завершающей фазой воспаления, направленной на восстановление поврежденной ткани. Возрастает число мезенхимальных камбиальных клеток, В- и Т-лимфоцитов, моноцитов. При размножении клеток в очаге воспаления наблюдаются клеточные дифференцировки и трансформации (схема XII): камбиальные мезенхимальные клетки дифференцируются вфибробласты; В-лимфоциты
Схема XII.Дифференцировка и трансформация клеток при воспалении
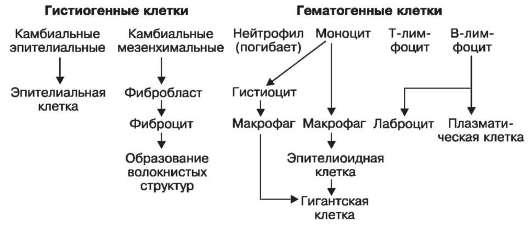 дают начало образованиюплазматических клеток. Т-лимфоциты, видимо, не трансформируются в другие формы. Моноциты дают начало гистиоцитам и макрофагам. Макрофаги могут быть
дают начало образованиюплазматических клеток. Т-лимфоциты, видимо, не трансформируются в другие формы. Моноциты дают начало гистиоцитам и макрофагам. Макрофаги могут быть
источником образования эпителиоидных игигантских клеток (клетки инородных тел и Пирогова- Лангханса).
На различных этапах пролиферации фибробластов образуются продукты их деятельности - белок коллаген игликозаминогликаны, появляются аргирофильные и коллагеновые волокна, межклеточное веществосоединительной ткани.
В процессе пролиферации при воспалении участвует и эпителий (см. схему XII), что особенно выражено в коже и слизистых оболочках (желудок, кишечник). При этом пролиферирующий эпителий может образовывать полипозные разрастания. Пролиферация клеток на поле воспаления служит репарации. При этом дифференцировка пролиферирующих эпителиальных структур возможна лишь при созревании и дифференцировке соединительной ткани (Гаршин В.Н., 1939).
Воспаление со всеми его компонентами появляется только на поздних этапах внутриутробного развития. У плода, новорожденного и ребенка воспаление имеет ряд особенностей. Первой особенностью воспаления является преобладание альтеративного и продуктивного его компонентов, так как они филогенетически более древние. Второй особенностью воспаления, связанной с возрастом, является склонность местного процесса к распространению и генерализации в связи с анатомической и функциональной незрелостью органов иммуногенеза и барьерных тканей.
Регуляция воспаленияосуществляется с помощью гормональных, нервных и иммунных факторов. Установлено, что одни гормоны, такие как соматотропный гормон (СТГ) гипофиза, дезоксикортикостерон, альдостерон, усиливают воспалительную
реакцию (провоспалительные гормоны), другие - глюкокортикоиды и адренокортикотропный гормон (АКЛТ) гипофиза, напротив, уменьшают ее (противовоспалительные гормоны).
Холинергические вещества, стимулируя выброс медиаторов воспаления, дей-
ствуют подобно провоспалительным гормонам, а адренергические, угнетая медиаторную активность, ведут себя подобно противовоспалительным гормонам. На выраженность воспалительной реакции, темпы ее развития и характер влияет состояние
иммунитета. Особенно бурно воспаление протекает в условиях антигенной стимуляции (сенсибилизация); в таких случаях говорят об иммунном, или аллергическом, воспалении (см. Иммунопатологические процессы).
Исходвоспаления различен в зависимости от его этиологии и характера течения, состояния организма и структуры органа, в котором оно развивается. Продукты тканевого распада подвергаются ферментативному расщеплению и фагоцитарной резорбции, происходит рассасывание продуктов распада. Благодаря клеточной пролиферации очаг воспаления постепенно замещается клетками соединительной ткани. Если очаг воспаления был небольшим, может наступить полное восстановление предшествующей ткани. При значительном дефекте ткани на месте очага образуется рубец.
Дата добавления: 2015-05-16; просмотров: 1220;
