Кардиоспазм
Считается, что кардиоспазм и ахалазия пищевода это синонимы одного заболевания, но есть и другая точка зрения. В настоящее время ряд авторов рассматривают кардиоспазм и ахалазию как два различных заболевания.
Кардиоспазм – стойкое спастическое сужение терминального отдела пищевода, проявляющееся дисфагией и в далеко зашедших стадиях сопровождающееся органическими изменениями его вышележащих отделов.
При ахалазии кардии отмечается отсутствие расслабления нижнего пищеводного сфинктера (НПС) во время акта глотания. Отсутствие этого рефлекса приводит к нарушению тонуса и моторики пищевода, что вызывает задержку прохождения пищевого комка.
Этиология и патогенез
Причины и механизмы возникновения кардиоспазма окончательно не выяснены. Существует теория врожденного спазма, инфекционная, рефлекторная, психогенная и другие. В настоящее время принято считать, что ключевую роль в патогенезе кардиоспазма играет повреждение межмышечного нервного сплетения пищевода. При гистологическом и иммуногистохимическом исследованиях удаленных препаратов показано, что при кардиоспазме в стенке пищевода определяется значительное уменьшение и даже исчезновение ганглиозных клеток; имеются признаки хронического воспаления. Гибель постганглионарных тормозных нейронов, иннервирующих область НПС, приводит к преобладанию стимулирующих импульсов, которые проводятся волокнами блуждающего нерва. В результате тонус НПС резко возрастает, а его расслабление во время глотания затрудняется.
Следует отметить, что биохимические аспекты моторики НПС до сих пор не расшифрованы окончательно. Исследования последнего времени указывают на важную роль окиси азота и, возможно, вазоактивного интестинального пептида (ВИП) как медиаторов нейро‑мышечной передачи.
К сожалению, причина повреждения интрамурального нервного сплетения (этиологический фактор кардиоспазма) остается неясной. В прошлом большое значение придавалось в данном аспекте тяжелым психическим травмам. Современные авторы активно обсуждают роль вирусной инфекции (в частности, герпетической) в генезе повреждения нервных структур пищеводной стенки.
В Южной Америке, особенно в Бразилии, встречается так называемая «вторичная» ахалазия кардии. В отличие от «первичной», идиопатической, этиология этой формы заболевания известна – она вызывается трипаносомой Круса и является одним из проявлений болезни Чагаса (американского трипаносомоза). Гибель ганглионарных клеток, локализующихся в клетках полых органов, приводит к развитию их патологического расширения (мегаколон, мегауретер, мегаэзофагус) и нарушению функции. Клиническая симптоматика первичной и вторичной ахалазии очень похожи, как и подходы к диагностике и лечению.
Некоторые авторы большое значение придают снижению содержания оксида азота, что приводит к нарушениям обмена кальция и передачи нервно‑мышечного импульса. При кардиоспазме наблюдается повышенное давление в зоне НПС, градиент пищеводножелудочного давления может достигать 200 мм рт. ст. и более, при норме 10 + 3 мм рт. ст. Для начальных стадий кардиоспазма характерна усиленная непропульсивная моторика пищевода. Морфологически находят дегенеративно‑дистрофические изменения в преганглионарных нейронах дорсальных ядер блуждающих нервов и в меньшей степени в постганглионарных нейронах ауэрбахова сплетения пищевода. В связи с нарушением центральной иннервации при кардиоспазме гладкая мускулатура НПС становится более чувствительной к своему физиологическому регулятору – эндогенному гастрину, вследствие чего наблюдается истинный спазм кардии.
При ахалазии кардии, напротив, поражаются преимущественно постганглионарные нейроны, в результате выпадает рефлекс раскрытия кардии на глоток. Манометрически находят нормальный или даже сниженный градиент пищеводно‑желудочного давления, наблюдается значительное ослабление моторики пищевода. При ахалазии нет условий для возникновения повышенной чувствительности гладкой мускулатуры НПС к гастрину – сохраняется центральная иннервация.
Но, как правило, нарушение рефлекса раскрытия кардии и моторики пищевода – два параллельных процесса, идущих одновременно, и многие авторы термины «кардиоспазм» и «ахалазия кардии» считают синонимами.
Классификация
В России наиболее распространена классификация кардиоспазма по стадиям, предложенная академиком Б. В. Петровским еще в 1957 году. В соответствии с этой классификацией выделяют четыре стадии заболевания: I – функциональный спазм непостоянного характера без расширения пищевода; II – стабильный спазм кардии с нерезким расширением пищевода (до 4–5 см); III – рубцовые изменения мышечных слоев кардии с выраженным расширением пищевода (до 6–8 см); IV – резко выраженный стеноз кардии со значительной дилатацией пищевода (более 8 см, иногда до 15–18 см), часто S‑образным его искривлением и эзофагитом. Схематически эти изменения представлены на рисунке 17.
Некоторые авторы выделяют 2 типа заболевания по характеру расширения пищевода. При первом типе, помимо стойкого нарушения проходимости терминального отдела пищевода, наблюдается его умеренное расширение выше суженного участка, и пищевод имеет цилиндрическую или веретенообразную форму. При втором типе – отмечается значительное удлинение и мешковидное расширение пищевода, нередко с S‑образным его искривлением (рис. 18).
Некоторые исследователи обозначают эти два типа болезни соответственно как кардиоспазм и ахалазию кардии.
Клиническая картина и данные объективного исследования
Для кардиоспазма характерна триада симптомов: дисфагия, боли и регургитация. Основной признак заболевания – дисфагия, то есть затруднение прохождения пищи по пищеводу во время глотания.
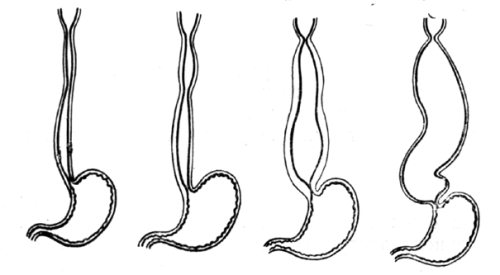
Рис. 17. Схема макроскопических изменений при I–IV стадиях кардиоспазма. (Приводится по: О. Д. Федорова. Кардиоспазм. М., 1973)
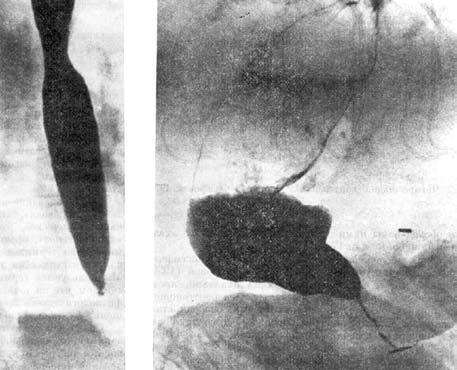
Рис. 18.
Рентгенологическая картина кардиоспазма:
А – при I типе заболевания; Б – при II типе заболевания. (Приводится по: В.Х. Василенко и соавт. Ахалазия кардии. М., 1976)
Чаще она развивается постепенно, но у ряда больных дебютирует остро, среди полного здоровья. В таких случаях «пусковым фактором» заболевания является негативный психоэмоциональный фон или внезапный стресс. И в дальнейшем эмоциональное состояние больного существенно влияет на выраженность дисфагии: волнения, отрицательные эмоции усиливают затруднение глотания. Спешка, усталость, проглатывание плохо пережеванных кусков пищи, питье холодной воды тоже вызывают усиление дисфагии. Запивание теплой водой и прием теплой полужидкой пищи ведут к облегчению глотания. Однако у некоторых пациентов наблюдается парадоксальная дисфагия – плотная пища проходит в желудок лучше, чем жидкая. Выделяют 4 степени дисфагии: I – затруднения, возникающие при прохождении по пищеводу плотной пищи (хлеб, мясо); II – затруднения, возникающие при приеме полужидкой пищи (каши, пюре); III – затруднения при приеме жидкостей; IV – полная непроходимость пищевода, когда больные не в состоянии проглотить и глоток воды, не проходит даже слюна.
Боли при кардиоспазме обычно возникают при глотании и локализуются за грудиной. Они связаны с растяжением стенок пищевода при нераскрытой НПС и исчезают после срыгивания или прохождения пищи в желудок. Иногда боли, напротив, появляются натощак или после рвоты. В этих случаях они вызваны эзофагитом и уменьшаются после приема пищи. У некоторых пациентов болевые ощущения могут быть довольно интенсивными, не связанными с актом глотания, возникать при волнении, физической нагрузке или даже в покое, в ночное время, вследствие некоординированных, спастических сокращений пищеводной мускулатуры.
Регургитация происходит на высоте затрудненного глотания после нескольких глотков. При этом сначала возникает ощущение «комка» в верхней части пищевода, а затем пищевые массы непроизвольно поступают в полость рта или наружу. При выраженной дилатации пищевода регургитация бывает реже, но обильнее. Иногда ее провоцирует перемена положения тела, чаще, когда пациент ложится или наклоняется кпереди. У большинства больных отмечается ночная регургитация, проявляющаяся вытеканием содержимого пищевода на подушку («симптом мокрой подушки»). В более тяжелых случаях возникает обильная регургитация с поперхиванием и приступами сильного кашля вследствие затекания пищевых масс в дыхательные пути, что может привести к аспирационной пневмонии.
Потеря массы тела в начале болезни выражена нерезко и отмечается примерно у половины больных. При прогрессировании дисфагии и регургитации наблюдается заметное похудание. У небольшой части пациентов развивается истощение.
Данные объективного исследования при кардиоспазме малоинформативны ввиду их неспецифичности. Общее состояние в I–II стадиях кардиоспазма хорошее. При III–IV стадиях наблюдается более выраженное понижение питания. У пациентов со значительной дилатацией пищевода может быть неприятный запах изо рта на почве гниения и брожения застаивающихся пищевых масс. Старыми авторами описывались расширение границ срединного притупления при перкуссии (ввиду расширения пищевода и смещения его вправо) и изменения аускультативных данных (шум плеска при наличии резко выраженного расширения пищевода).
Лабораторная и инструментальная диагностика
Лабораторные методы при кардиоспазме малоинформативны, поскольку при этом заболевании не бывает специфических патологических изменений. При развитии осложнений (например, аспирационной пневмонии, дисфагии III–IV степени) могут быть лейкоцитоз, электролитные нарушения и т. д. Диагностика кардиоспазма, прежде всего, основывается на рентгенологическом и эндоскопическом исследованиях.
Главный рентгенологический симптом кардиоспазма – выявление конического сужения дистального отдела пищевода, которое описывается как симптом «мышиного хвоста», «птичьего клюва» и т. д. Вышележащие отделы пищевода при этом обычно расширены соответственно стадии заболевания. Дилатация пищевода может быть выражена очень значительно. При рентгеноскопии выявляют нераскрытое кардии при акте глотания, нарушение перистальтики пищевода. Нередко обнаруживают отсутствие газового пузыря желудка и рентгенологические признаки аспирационных легочных осложнений кардиоспазма (рис. 19).
Эндоскопическое исследование пищевода позволяет выявить степень расширения его проксимальных сегментов, характер и выраженность эзофагита и метапластических изменений. Почти всегда при кардиоспазме удается пройти эндоскопом в желудок, в отличие от рака кардии и органических рубцовых стенозов (симптом Мельцера).
Манометрия пищевода позволяет подтвердить диагноз кардиоспазма и дифференцировать его от других нейромышечных заболеваний. Основной манометрический признак кардиоспазма – полное или частичное нерасслабление НПС при глотании. Часто наблюдаются повышение «давления покоя» НПС и ослабление перистальтики гладкой мускулатуры пищевода.
За рубежом для исследования опорожнения пищевода при подозрении на кардиоспазм широко применяют радионуклидное исследование (сцинтиграфию). Для этого больным дают выпить специальный раствор, содержащий радиофармпрепарат, а затем в динамике регистрируют интенсивность вызванного им гамма‑излучения в гамма‑камере. Это позволяет уточнить время частичного или полного опорожнения пищевода, которое при кардиоспазме, как правило, в значительной степени замедлено.
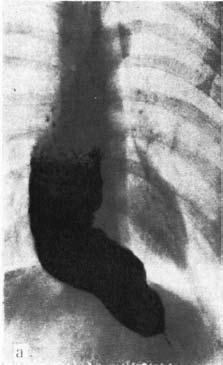
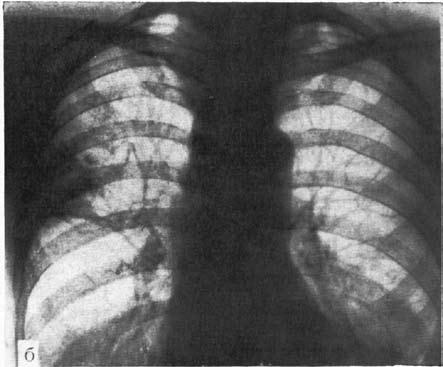
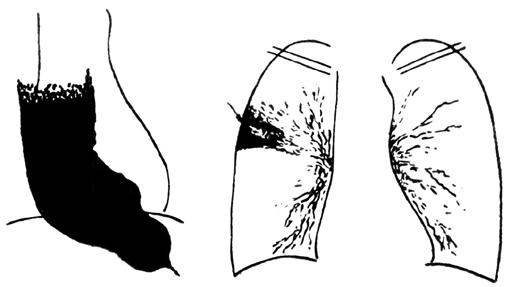
Рис. 19. Рентгенологические симптомы кардиоспазма: А – пищевод значительно расширен, удлинен и смещен вправо; дистальный его отрезок резко сужен, газовый пузырь желудка отсутствует; Б – справа в верхней доле легкого явления пневмосклероза как следствие многократных аспирационных пневмоний. (Приводится по: Е.М. Каган. Рентгенодиагностика заболеваний пищевода. М., 1968) Дифференциальная диагностика
Кардиоспазм дифференцируют с опухолями пищевода и кардиального отдела желудка, рубцовыми стенозами и дивертикулами пищевода, грыжей пищеводного отверстия диафрагмы (ГПОД). Все эти заболевания имеют сходную клиническую симптоматику, а в качестве ведущего симптома выступает дисфагия.
Злокачественные опухоли пищевода и кардии встречаются значительно чаще кардиоспазма. Обычно заболевают люди старше 50–60 лет, тогда как ахалазией страдают более молодые пациенты. Рак развивается в течение нескольких месяцев и сопровождается прогрессирующей дисфагией, параллельным ухудшением общего состояния (нарастанием слабости, потери массы тела, вплоть до истощения, анемии), тогда как кардиоспазм – длительное заболевание с медленным течением и годами сохраняющимся хорошим общим состоянием пациентов.
Сужение кардии при раке может сопровождаться супрастенотическим расширением пищевода, что бывает и при кардиоспазме. Однако для рака характерно нарушение целости контура стенки пищевода и желудка с образованием дефекта наполнения. Стенозированный участок при этом бывает неровным, нечетким, как бы изъеденным. Эвакуация бария в желудок происходит непрерывной суженной струйкой. Газовый пузырь желудка при раке, в отличие от кардиоспазма, хорошо выявляется (рис. 20).
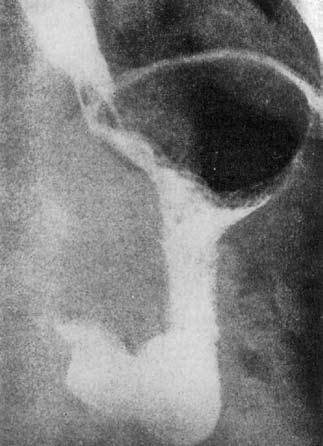
Рис. 20. Сужение пищеводножелудочного перехода при раке кардиального отдела желудка. Газовый пузырь желудка виден отчетливо. (Приводится по: Б. Е. Петерсон. Рак проксимального отдела желудка. 1972)
При ГПОД более выражен болевой синдром, жгучие боли локализуются за грудиной и в эпигастрии. Дисфагия редко бывает тяжелой, регургитация обычно отсутствует. В рентгенологической картине может быть сходство с кардиоспазмом I стадии. Для дифференциальной диагностики необходимо провести исследование в горизонтальном положении, при котором легко можно увидеть скользящую ГПОД. У некоторых больных симптомы дивертикула пищевода сходны с таковыми при кардиоспазме. Точный диагноз можно поставить на основании рентгенологического исследования. В сложных и диагностически неясных случаях для уточнения диагноза показано проведение КТ грудной и брюшной полости, а также эндосонографии пищевода.
Лечение
При I–II стадиях кардиоспазма проводят консервативное лечение. Ведущее место в лечении III–IV стадии заболевания принадлежит хирургическим методам.
Консервативное лечение. Для лечения кардиоспазма применяли множество лекарственных препаратов из самых разных фармакологических групп. Однако более или менее клинически успешным оказалось использование только двух из них: нитратов и блокаторов кальциевых каналов. Эти препараты снижают тонус НПС и облегчают глотание. Считается, что нитраты более эффективны, но имеют труднопереносимый побочный эффект – сильную головную боль. Блокаторы кальциевых каналов (нифедипин, дилтиазем) переносятся больными существенно лучше. Новейшие исследования доказывают перспективность использования силденафила (виагры) в терапии нейромышечных заболеваний пищевода.
Лекарственное лечение кардиоспазма лучше применять на ранних стадиях и при так называемом первом типе болезни, когда перистальтика гладкой мускулатуры пищевода еще сохранена.
На практике, когда лекарственное лечение не дает должного клинического эффекта (а это бывает нередко), «стартовым» методом лечения наиболее часто является кардиодилатация (КД). Сущность ее заключается в насильственном растяжении и частичном разрыве мускулатуры дистального сегмента пищевода.
В прошлом широко применялся металлический кардиодилататор Штарка, в котором есть 4 расширяющиеся бранши, присоединенные к металлическому стержню. На противоположном конце укреплена рукоятка с кремальерой, обеспечивающей дозированное раскрытие браншей (рис. 21).
Современные кардиодилататоры состоят из резинового или полихлорвинилового зонда с укрепленным на его конце баллоном (рис. 22).
Дилататор вводят под рентгенологическим или эндоскопическим контролем. Баллон наполняют воздухом или водой; при этом достигают определенного уровня давления. Технические детали вмешательства (вид анестезии, длительность экспозиции дилататора, режим повторных КД) широко варьируют в разных клиниках. Так, в нашей клинике в течение многих лет с успехом применялась КД резиновым гидродилататором под давлением 300 мм рт. ст. с экспозицией 1 час. Вмешательство осуществлялось под общей анестезией.

Рис. 21. Кардиодилататор Штарка. (Приводится по: 0. Д. Федорова. Кардиоспазм. М., 1973)
В большинстве случаев после КД наблюдается улучшение в виде облегчения глотания и регресса других симптомов заболевания. В поздних стадиях кардиоспазма (III–IV) нередко возникают показания к операции, поскольку КД малоэффективна или опасна ввиду высокого риска разрыва пищевода. Наиболее распространенными операциями при кардиоспазме являются эзофагокардиомиотомия (операция Геллера) и ее многочисленные модификации. Рассечение мышечной оболочки дистального отрезка пищевода устраняет нерасслабление НПС при глотании. Современный вариант операции Геллера предусматривает рассечение мышечной оболочки вертикальным разрезом на передней стенке пищевода с небольшим (1–2 см) заходом на кардию (рис. 23).
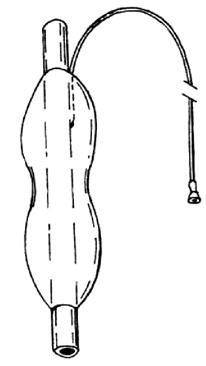
Рис. 22. Баллонный пневмокардиодилататор, надеваемый на дистальную часть эндоскопа. (Приводится по: Ю.И. Галлингера, Э.А. Годжелло. Оперативная эндоскопия пищевода. М., 1999)
Многие хирурги для достижения более надежного результата иссекают полоску пищеводной стенки. Эзофагокардиомиотомию можно выполнять как абдоминальным, так и торакальным доступом. 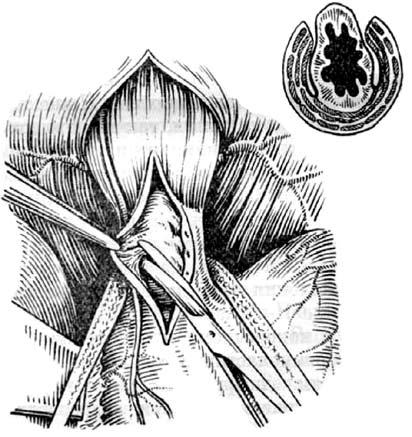
Рис. 23. Эзофагокардиомиотомия по Геллеру. Этап отделения слизистой оболочки от мышечного слоя пищевода и кардии. (Приводится по: А. А. Шалимов и соавт. Хирургия пищевода. М., 1975)
Однако технически безупречное производство операции Геллера возможно далеко не всегда. При значительных склеротических изменениях стенки пищевода полноценную миотомию выполнить трудно. Высок риск случайного повреждения слизистой, что приводит к развитию после операции медиастинита и/или перитонита. В отдаленном периоде может образоваться эпифренальный дивертикул пищевода вследствие пролабирования слизистой через миотомическое отверстие. Нередко возникает ретракция рассеченных тканей с дальнейшим рубцеванием, что ведет к рецидиву дисфагии. Избыточная миотомия влечет за собой развитие тяжелого рефлюкс‑эзофагита. Для устранения недостатков оригинальной операции были предложены ее модификации, которые предусматривали укрытие миотомического отверстия: при способе Б. В. Петровского – лоскутом, выкроенным из диафрагмы, В. И. Колесова – сальником на ножке (рис. 24 и 25).
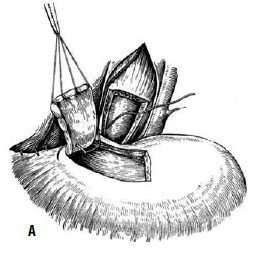
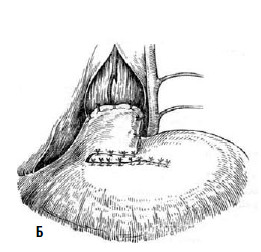
Рис. 24. Эзофагокардиопластика диафрагмальным лоскутом по Б.В. Петровскому: А – иссечен участок мышечного слоя пищевода, сформирован диафрагмальный лоскут, начато подшивание последнего к мышечным краям пищевода; Б – лоскут фиксирован, дефект в диафрагме ушит. (Приводится по: О. Д. Федорова. Кардиоспазм. М., 1973)
Однако отдаленные исходы и таких операций оказались не очень хорошими – в первую очередь, вследствие грубого рубцевания перемещенных лоскутов. Гораздо лучшим способом оказалось укрытие линии разреза передней стенкой дна желудка, которую поворачивают на 180♦ (рис. 26). 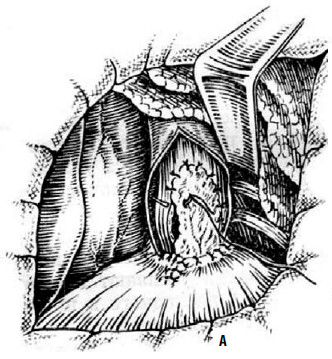
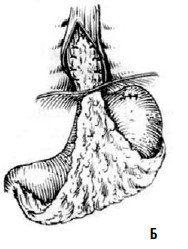
Рис. 25. Эзофагокардиомиотомия с оментопластикой по В. И. Колесову: А – подшивание сальника к краям рассеченных мышц пищевода; Б – окончательный вид операции. (Приводится по: А.А. Шалимов и соавт. Хирургия пищевода. М., 1975)
Эта операция позволяет сделать угол Гиса более острым и тем самым уменьшить риск развития недостаточности кардии и пептического эзофагита в послеоперационном периоде. 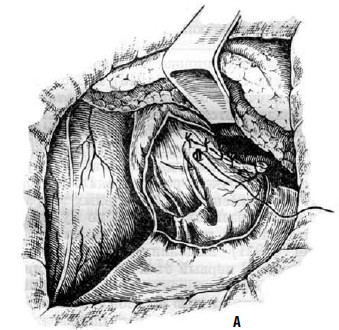
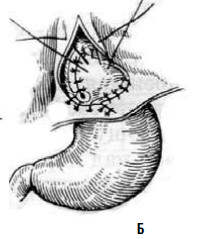
Рис. 26. Эзофагокардиомиотомия с частичной фундопликацией по методике Т. А. Суворовой: А – подшивание дна желудка к краям рассеченных мышц пищевода; Б – окончательный вид операции. (Приводится по: А. А. Шалимов и соавт. Хирургия пищевода. М., 1975)
Очень серьезным достижением последних десятилетий явилась разработка методики выполнения такой операции при помощи эндовидеохирургической техники. Во многих зарубежных клиниках в настоящее время лапароскопическая эзофагокардиомиотомия с частичной фундопликацией является «золотым стандартом» хирургического вмешательства при кардиоспазме. Однако на поздних стадиях заболевания (III–IV) эзофагомиотомию выполнять не следует, поскольку у таких больных весь пищевод патологически изменен, а перистальтика его резко ослаблена или отсутствует. Тогда патогенетически обоснованным методом лечения является субтотальная резекция или экстирпация пищевода с его одноэтапной пластикой, как правило, желудочным трансплантатом. Резекционное вмешательство показано также после неэффективной миотомии и при развитии пептической стриктуры пищевода (как осложнение рефлюкс‑эзофагита). Опыт нашей клиники показал хорошие непосредственные и отдаленные результаты таких операций.
Таким образом, как уже указывалось, в самых общих чертах можно сформулировать зависимость метода лечения кардиоспазма от стадии заболевания: в I стадии – применяют лекарственное лечение, во II–III – КД, в III–IV – хирургическое вмешательство.
Дата добавления: 2015-05-13; просмотров: 1792;
