ДАТИРОВКА С ПОМОЩЬЮ РАДИОАКТИВНОСТИ
Для геологов главным судьей‑хронометристом является радиоактивность горных пород. К счастью, существует много естественно встречающихся радиоактивных изотопов, обладающих свойствами, делающими их полезными для решения задач геологической хронологии. Их важность нельзя переоценить. Только благодаря им появилась возможность составить историю Земли, которая рассказывается в этой книге.
Как же можно использовать свойство радиоактивности для определения возраста горных пород или для оцифровки временной шкалы? Тема эта является весьма сложной и специальной. Тысячи научных статей и много книг были написаны об этом предмете. Здесь мы можем дать читателю лишь краткий очерк, приведя несколько примеров. Но основная предпосылка метода, в сущности, очень проста. Радиоактивные изотопы распадаются с постоянной скоростью. В этом отношении они совершенно аналогичны обычным часам. Мы знаем, что каждую минуту часы отстукивают шестьдесят секунд. Мы также знаем, что в любом образце горной породы, который содержит уран, около полутора процентов этого урана распадается, образуя свинец, каждые 100 миллионов лет. Измеряя количество урана, которое распалось в течение жизни какого‑нибудь определенного образца (или, наоборот, количество свинца, образовавшегося в результате распада), можно определить возраст образца.
Большинство химических элементов периодической таблицы Менделеева имеют по несколько изотопов. Как уже рассказывалось в главе 2, все изотопы одного элемента ведут себя в химическом отношении одинаково. Каждый из них имеет одинаковое число протонов в ядре своих атомов и одинаковое число электронов, окружающих это ядро. Однако каждый из изотопов имеет слегка отличный вес, поскольку ядра разных изотопов содержат неодинаковое число нейтронов. Вид изотопа определяется числом, которое означает сумму протонов и нейтронов в ядре атома (и тем самым его вес, точнее – массу). Таким образом, в каждом глотке воздуха, который вы вдыхаете, большая часть атомов кислорода принадлежит изотопу кислород 16, но некоторые принадлежат изотопу кислород 18 и совсем ничтожное число – изотопу кислород 17. Но что касается вашего тела, то большая часть его состоит из всех изотопов кислорода.
Радиоактивные изотопы неустойчивы. Радиоактивный распад направлен на достижение устойчивости с помощью изменения соотношения между числом протонов и нейтронов в ядрах атомов. Это осуществляется путем выбрасывания некоторых частиц из ядра с большой энергией, и в этом процессе образуется другой химический элемент. Например, мы видели, что уран, распадаясь, образует свинец (хотя в этом конкретном случае преобразование ядер урана в свинец включает целую серию радиоактивных распадов, а не один‑единственный этап). Явление радиоактивности было открыто в последние годы девятнадцатого столетия и с тех пор интенсивно изучается. Ученые быстро узнали путем экспериментов, что радиоактивность является статистическим явлением, то есть что каждый радиоактивный изотоп характеризуется определенной вероятностью того, что он распадется в заданный промежуток времени. Это легче всего представить, вообразив большое количество радиоактивных атомов в стакане. Представим себе, что мы можем их видеть и определять их число в любой момент времени. Если мы проделаем такое наблюдение через какой‑нибудь промежуток времени, скажем, через минуту, то обнаружим, что определенная часть атомов распадется; при наблюдении еще через минуту распадется та же часть оставшихся атомов и так далее. Поскольку радиоактивность является статистическим явлением, и особенно если количество атомов в стакане изначально было мало, то доля распадающихся атомов может слегка колебаться от минуты к минуте, но в среднем она будет постоянной. Тот же эксперимент, но проведенный в разное время и при широком разнообразии окружающих условий, даст тот же результат. Это указывает на то, что вероятность распада определенной доли данного изотопа за определенное время является постоянной величиной. Закономерность распада удобно выразить через время полураспада изначального количества атомов данного изотопа в образце породы, то есть время распада половины изначальных атомов изотопа. Математически период полураспада прямо пропорционален величине постоянной распада и для большинства радиоактивных изотопов он определен с высокой точностью. Именно эти данные являются ключом ко всем применяющимся в геологии методам «абсолютного» датирования.
Возможно, вы поняли из этого описания, что радиоактивный распад описывается экспоненциальным законом распределения: количество распадающихся за каждую единицу времени атомов в начале процесса велико, но с течением времени становится все меньше. Именно доля атомов, которые распадаются в каждый из одинаковых промежутков времени, оказывается постоянной, что видно из рис. 6.2.
Почему же в природе существуют неустойчивые радиоактивные изотопы? Вместе с устойчивыми элементами большая часть их образуется в результате ядерных реакций в недрах звезд или же при взрывах сверхновых звезд которые регулярно происходят в нашей Галактике. Они являются частью того вещества, которое вошло в состав Земли при ее образовании; изотопы с очень долгим периодом полураспада распались лишь частично. Они все еще встречаются на Земле. Но существуют и изотопы со столь коротким периодом полураспада, что любые их количества, существовавшие в период образования Земли, давно уже полностью распались. Тот факт, что они все же встречаются на Земле, говорит о том, что они продолжают образовываться в каких‑то ныне протекающих процессах.
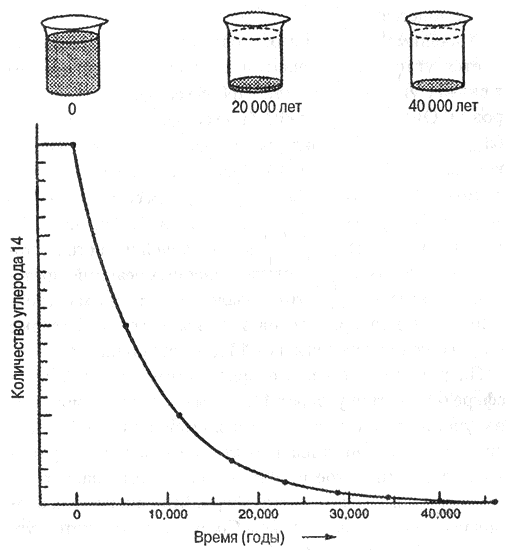
Рис. 6.2. Количество радиоактивного изотопа углерод 14 (здесь оно показано в произвольных единицах), содержащееся, например, в растении, остается постоянным, пока оно живо и обменивается СO2 с атмосферой. После того как оно умирает (отмечено цифрой 0 на графике), содержание в нем углерода 14 уменьшается наполовину каждые 5700 лет, в связи с его распадом до нерадиоактивного азота. Точки на кривой расположены через интервал времени, равный времени полураспада. Очевидно, что после пяти или шести таких периодов остается очень мало углерода 14. Тот же процесс показан и в верхней части рисунка в условной форме исчезновения углерода 4 из первоначально полного стакана.
Хорошим примером изотопов последней категории является углерод 14 – изотоп, столь знакомый многим в связи с углеродным (или карбоновым) методом датировки. Он имеет короткий (по геологическим масштабам) период полураспада, равный 5700 лет, так что никакое количество углерода 14, обнаруживаемое в наши дни, не может быть остатком, сохранившимся со времен образования Земли (как должно быть очевидно из рис. 6.2). Наоборот, запасы этого изотопа на нашей планете постоянно пополняются в результате ядерных реакций, протекающих в атмосфере. Это оказалось счастливым обстоятельством для археологов и климатологов, которые широко используют углерод 14 для датировки.
Ядерные реакции, благодаря которым в земной атмосфере образуется углерод 14, вызываются космическим излучением, то есть потоками элементарных частиц – преимущественно отдельных атомов, – которые пронизывают космическое пространство и часто падают на Землю, пронизывая ее атмосферу. Многие из этих атомов имеют своим источником Солнце и разгоняются, устремляясь в космос в больших количествах в моменты, когда огромные языки пламени – солнечные протуберанцы – выбрасываются Солнцем на миллионы миль от солнечной поверхности. Некоторая часть космического излучения с еще большими энергиями частиц – это путешественники из областей Галактики, далеко отстоящих от Солнечной системы. Но независимо от их происхождения, когда очень быстрые частицы космического излучения сталкиваются с атомами земной атмосферы, возникают ядерные реакции, подобно тому, как это происходит в созданных человеком ускорителях элементарных частиц. Побочным продуктом этих реакций являются нейтроны; когда произведенный космическим лучом нейтрон ударяется в устойчивый атом изотопа азота под номером 14 и захватывается им (азот является самым мощным элементом в составе атмосферы), выбивая из него один протон, возникает радиоактивный углерод 14.
Большая часть углерода в составе земной атмосферы связана с кислородом и образует углекислый газ (диоксид карбона). Такова судьба и образованных с помощью космических лучей атомов радиоактивного углерода 14, так что в каждой порции углекислого газа, взятого из атмосферы, содержится постоянная доля атомов углерода 14. Вследствие того, что в живых организмах углерод, входящий в их состав, в конечном итоге образуется из атмосферы с помощью происходящего в растениях фотосинтеза, он содержит ту же постоянную долю углерода 14, что и атмосфера. Это является основой для использования этого радиоактивного изотопа в качестве хронометра.
Датирование с помощью углерода 14 было применено для определения возраста Туринской плащаницы, раковин из мусорных куч североамериканских индейцев, доисторических извержений вулканов на Гавайских островах. Как же конкретно производится датирование определенных образцов с помощью этого метода? Во‑первых, нужно найти материал, который содержит углекислоту (и значит, углерод 14), заимствованную из атмосферы. Для этого подойдет все, что угодно, лишь бы оно содержало углерод и было живо во время события, время которого мы хотим определить, хотя некоторые вещества более пригодны для этого, чем другие. Часто используются растительные остатки, как, например, древесина или даже древесный уголь. Когда растение умирает или падает под ударами топора, или сгорает в лавовом потоке и поглощается им, оно перестает связывать углерод из атмосферы; начиная с этого момента содержащийся в нем радиоактивный углерод 14 начинает распадаться в соответствии с хорошо известной величиной – постоянной распада и с графиком, показанным на рис. 6.2. Если образец старого дерева имеет возраст, точно соответствующий периоду полураспада углерода 14, то есть 5700 лет, то он содержит в точности 50% количества этого изотопа, которое содержится в современных растениях; если его возраст равен двойному периоду полураспада – то 25% и так далее. Из рис. 6.2 очевидно, что после времени, равного нескольким периодам полураспада, остается не так уж много радиоактивного изотопа. И все же современная техника позволяет определить исключительно малые количества углерода 14 и таким образом измерить возраст образцов до сорока или пятидесяти тысяч лет. Это составляет более восьми периодов полураспада, поэтому в образце такого возраста содержится 1/254 часть первоначального количества углерода 14.
Единственная неопределенность при использовании этого метода заключается в содержании углерода 14 в древней атмосфере – оно, возможно, отличалось от сегодняшнего. Однако существуют различные способы проверить эту возможность – например, путем калибровки возраста, определенного радиокарбоновым методом, да и с помощью других методов. Далее при отмеченных флуктуациях содержания углекислоты в древней атмосфере эти проверки показали, что в общем и целом допущение о приблизительно постоянном содержании углерода 14 в атмосфере хорошо выдерживается для того отрезка времени, для которого пригоден этот метод.
Это краткое описание дает пример того, как можно использовать радиоактивные изотопы для определения возраста объектов или событий. Тем не менее период полураспада углерода 14 столь мал, что этот изотоп можно использовать для установления хронологии лишь очень недавнего прошлого. Для остальной же части геологической шкалы времени применяются гораздо более долгоживущие изотопы; способы их использования тоже различаются.
В главе 2 мы упоминали об изотопах свинца и об их полезности для измерения возраста Земли и датирования зерен устойчивого к выветриванию минерала циркона. Мы узнали, что различные изотопы свинца являются устойчивыми конечными продуктами распада радиоактивных урана и тория. Ураново‑свинцовый метод был по существу первым из всех применяющихся сейчас способов определения возраста пород с помощью радиоактивного распада; он все еще является одним из самых полезных в геологии. Другие общеупотребительные пары изотопов используют распад изотопа калия до изотопа газа аргона или распад рубидия 87 до стронция 87. Исходный изотоп в каждом случае является широко распространенным компонентом пород земной коры; период его полураспада достаточно длинный, чтобы метод можно было применить для всей истории Земли.
В принципе методы, использующие долгоживущие радиоактивные изотопы, подобны методу, использующему углерод 14, но есть некоторые важные отличия. Одно из них заключается в том, что исходные («родительские») изотопы не возникают на Земле непрерывно и постоянно; количество их постепенно уменьшается в результате радиоактивного распада. Поэтому сейчас на Земле имеется значительно меньше урана, чем в период формирования – большая часть его распалась, превратившись в свинец.
Для обычно используемых методик датирования процедура состоит в измерении количества «дочернего» изотопа, который образовался за время жизни образца, а не «родительского», оставшегося в образце, как при использовании углерода 14. Тем самым мы избегаем необходимости знать количество родительского изотопа, присутствовавшего в образце в момент, когда были запущены радиоактивные часы. Поскольку каждый «родительский» атом распадается, производя «дочерний», то количество последних всегда равно количеству распавшихся «родительских» атомов.
Хорошим примером того, как работает эта методика, является калий‑аргоновый метод. Калий 40 – единственный радиоактивный из трех встречающихся в природе изотопов калия. Хотя калий 40 не так уж распространен и составляет всего около 0,01 процента от общего количества атомов калия, сам калий является обычным компонентом минералов земной коры, что делает его весьма полезным для датирования горных пород – как имеющих возраст Земли, так и молодых, около 100 000 лет или даже меньше. Дочерним изотопом для этой реакции распада является аргон 40 – газ; хотя аргон не столь уж редкий элемент – в атмосфере он содержится в количестве около одного процента, – большинство изверженных пород, особенно вулканические породы, прорвавшиеся на поверхность земли, при своем образовании вовсе не содержат аргон 40. Любой аргон, который был растворен в расплавленной лаве, просто уходит в атмосферу во время извержения вулкана. Поэтому все количество аргона 40, определенное в древней вулканической породе, должно было образоваться в результате радиоактивного распада калия 40 за время жизни образца. Поскольку период полураспада калия 40 хорошо известен, не так уж сложно вычислить время, необходимое для накопления этого количества аргона. Некоторые самые обычные минералы, как, например, полевой шпат или слюда, богаты калием и поэтому представляют собой особенно чувствительные хронометры…
Другие долгоживущие радиоактивные изотопы, используемые в геохронологии, применяются аналогичным образом, хотя каждый имеет свои особенности. Поскольку в этих методах используются разные химические элементы, некоторые лучше, чем другие, подходят для датирования конкретных пород. Однако часто случается, что одну и ту же породу можно датировать разными методами. Хотя используемые при этом радиоактивные изотопы могут иметь весьма различные значения периода полураспада, а «родительские» и «дочерние» изотопы – совершенно разные химические свойства, возраст обычно определяется один и тот же. Это придает геологам уверенность в правильности каждого метода, а также подтверждает точность определения периодов полураспада, используемых в расчетах.
Но что же здесь, собственно, датируется? Приведенный выше пример вулканической породы, накапливающей аргон 40 с момента ее выхода на поверхность в виде лавы, очень прост: определяется время извержения, равное возрасту вулканической породы. А как быть в случае осадочной или метаморфической породы? Применимы ли к ним такие же правила? Ответом будет: и да и нет.
Рассмотрим случай осадочной породы. Предположим, что богатый калием минерал отобран из образца для датировки калий‑аргоновым методом; его возраст определяется в 300 миллионов лет. Является ли эта дата временем образования осадка? В общем случае ответ будет отрицательным, поскольку многие из минералов, встречающихся в осадочной породе, могут быть осколками ранее существовавших пород. Они были перенесены из своего первоначального источника к месту отложения реками или океанскими течениями. Измеренный возраст для зерен богатого калием минерала, скорее всего, правилен, но он, вероятно, отражает время образования гранита, из которого эти минеральные зерна были выветрены, а не время его отложения как части осадочной породы. В этом случае можно утверждать только то, что данная осадочная порода не может быть старше 300 миллионов лет. Она должна быть моложе, чем ее составные части, а насколько моложе – это не всегда легко определить.
В случае метаморфической породы задача еще больше осложняется. Все методы датирования в определенной степени чувствительны к температуре, особенно калий‑аргоновый метод. Если нагреть богатый калием минерал, то некоторое количество накопившегося газообразного аргона 40, вероятно, опять диффундирует в атмосферу. Поскольку метаморфизм почти неизменно связан с повышением температуры пород, большинство пород во время метаморфизма теряет часть своего аргона. Если эта потеря является полной, то радиоактивные часы тем самым переводятся на нулевое время; определенный по ним возраст породы – это возраст ее метаморфизма. Но в общем случае потеря аргона является лишь частичной и, более того, обычно невозможно установить, какая часть аргона потеряна. Иногда эту трудность можно обойти, используя несколько разных методов датировки или минералов с разной чувствительностью к температуре. Тем не менее полученную таким образом информацию не всегда легко интерпретировать. И все же в последнее время были достигнуты большие успехи в понимании поведения различных элементов вроде аргона при нагревании; в некоторых случаях оказалось возможным реконструировать температурную историю породы на основании тщательного анализа ее изотопного состава. Этот подход оказался особенно плодотворным при изучении истории горных цепей, таких, например, как Гималаи, в которых глубоко погребенные (и поэтому очень горячие) породы были подняты на более холодные этажи близ земной поверхности, где они снова начали сохранять свой аргон. При благоприятных условиях хронология поднятия горных массивов определяется достаточно точно.
Дата добавления: 2015-05-08; просмотров: 2190;
