ЗНОШУВАННЯ І РУЙНУВАННЯ РІЗАЛЬНОГО ІНСТРУМЕНТУ.
У залежності від умов існування речовини можуть знаходитися у твердому, рідкому, газоподібному стані або у вигляді плазми. У газоподібному стані речовини заповнюють увесь об'єм посудини, в якій знаходяться. Вони мають здатність стискатися і утворюють однорідні суміші. Молекули у газах рухаються хаотично. Для ідеальних газів, в яких не враховується міжмолекулярна взаємодія, тиск р, об'єм V і число молів газу n зв'язані між собою рівнянням Мендєлєєва-Клапейрона:
pV = nRT. , (4.1)
Під час охолодження газ конденсується перетворюючись на рідину. Відстань між молекулами в рідинах значно менша, ніж у газах. Молекули вільно переміщуються відносно одна одної, тому рідини здатні текти і приймати форму посудини, в якій вони поміщені. Тепловий рух молекул призводить до їх неупорядкованого розташування. У той же час сусідні часточки розташовуються у рідині не хаотично, а більш-менш упорядковано. Рідини характеризуються ізотропністю, тобто ідентичністю властивістю у будь-якій точці і тотожністю у будь-якому напрямку.
У твердому агрегатному стані середня відстань між часточками дорівнює їх розмірам, а енергія їх взаємодії значно більша, ніж у рідинах. Основним видом руху часточок є коливальний рух поблизу фіксованого рівноважного положення. Тверді речовини можуть бути в аморфному або кристалічному стані. В аморфному стані структура речовини не упорядкована. Аморфна речовина ізотропна, тобто її можна розглядати як переохолоджену рідину. Плавляться такі речовини не за певної температури, а у деякому інтервалі температур. Аморфними речовинами є скло, органічні полімери. Більшість твердих тіл є кристалами – системами, в яких часточки, що їх утворюють (атоми або іони) розташовані у тримірному просторі регулярно і упорядковано. На відміну від аморфних речовин у кристалах значення параметрів будуть різними у різних напрямках, тобто кристали анізотропні. Перехід кристалів із твердого стану в рідкий відбувається стрибкоподібно за певної температури, яка називається температурою плавлення.
Типовими представниками кристалічних речовин є метали, деякі мінерали. На лекції надається характеристика структури і загальних фізико-хімічних властивостей металів: наявності металічного блиску, пластичності, здатності проводити тепло і струм.
4.2Фазові рівноваги
Термодинамічні системи поділяються на гомогенні і гетерогенні. Система, що складається лише з однієї фази називається гомогенною, якщо ж у системі є дві і більше фаз – гетерогенною. Фазою називають частину системи, яка має однакові фізико-хімічні властивості і відокремлена від інших фаз видимою межею поділу. Компонентом називається хімічно індивідуальна речовина, яка будучі виділена із системи може існувати у вільному стані тривалий час. Фазовими переходами називаються процеси переходу компонентів з однієї фази в іншу, які не супроводжуються хімічними реакціями, наприклад процеси плавлення, конденсації, розчинення. За незмінності зовнішніх умов у системі встановлюється фазова рівновага – стан системи коли швидкість переходу компонентів із однієї фази в іншу дорівнює швидкості їх зворотного переходу.
Основним законом фазової рівноваги є правило фаз Гіббса:
С = К – Ф + n, (4.2)
де Ф – число фаз у системі; n – число зовнішніх факторів, що впливають на рівновагу в системі; С – число ступенів вільності, яке дорівнює числу факторів, які можна довільно змінювати у певних межах, не змінюючи при цьому фазовий стан системи; К – число незалежних компонентів – мінімальна кількість компонентів, яка необхідна для утворення усіх фаз системи.
Можливість і напрямок фазових переходів речовин визначається величиною їх хімічних потенціалів m – функції, що характеризує стан компонента у фазі за певних зовнішніх умов. Вільна енергія відкритих систем залежить не тільки від їх температури, тиску і об'єму, але й від кількості речовини компонентів у системі. При доданні у систему або вилучені з неї певної кількості речовини будь-якого компоненту її внутрішня енергія, а відповідно, і вільна енергія будуть змінюватися.
Хімічний потенціал компоненту визначається за зміною значень термодинамічних потенціалів системи під час додання до неї (або вилучення) 1 моля цього компоненту. Математично це визначення можна записати:
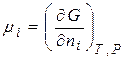 =
= 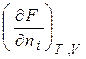 . (4.3)
. (4.3)
В інтегральному вигляді рівняння (4.3.) буде мати вигляд:
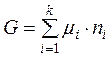 . (4.4)
. (4.4)
Тобто термодинамічні потенціали систем дорівнюють сумі добутків хімічних потенціалів усіх компонентів системи на їх кількість за умов сталості певних параметрів: температури, об’єму, тиску.
Хімічний потенціал залежить від концентрації компоненту у системі і за сталої температури визначається рівнянням:
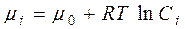 , (4.5)
, (4.5)
де Сі – концентрація і-го компоненту у розчині, m0 – стандартний хімічний потенціал компоненту (значення хімічного потенціалу за стандартних умов).
Самочинний перехід компоненту здійснюється з фази, де його хімічний потенціал більший, до фази, де його потенціал менший. Перехід супроводжується зменшенням значення хімічного потенціалу компоненту в першій фазі і збільшенням його в другій. Внаслідок чого різниця між хімічними потенціалами компонентів в обох фазах зменшується, і коли значення хімічних потенціалів зрівняються, досягається стан фазової рівноваги. Таким чином, хімічний потенціал є критерієм, що характеризує здатність компонентів до виходу з фази шляхом випаровування, кристалізації, розчинення тощо.
4.3 Фізико-хімічний аналіз
Задачею фізико-хімічного аналізу (ФХА) є вивчення залежностей між фізичними властивостями рівноважних систем та їх складом і зовнішніми факторами, що впливають на стан рівноваги. Основним принципом ФХА є принцип безперервності М.С.Курнакова: "При поступовій неперервній зміні параметрів системи (тиску, температури або складу фаз) властивості системи також змінюється безперервно; якщо ж одна з фаз зникає або з’являється нова, то властивості системи змінюються стрибкоподібно". На підставі дослідницьких результатів будують діаграми стану (фазові діаграми), які графічно описують одержані залежності. На цих діаграмах широко застосовуються геометричні поняття: окремі фази являють собою частину простору, двофазні рівноважні системи – лінії і, трифазні системи зображують крапками. Аналіз фазових діаграм дозволяє виявляти наявність у системі хімічних сполук, їх склад, стійкість, температури фазових переходів тощо.
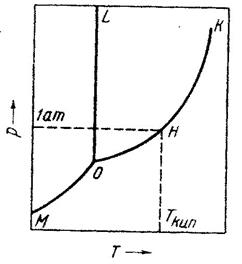 Діаграма стану води. Розглянемо діаграму стану однокомпонентної системи на прикладі діаграми стану води (рис. 4.1), яка характеризує зміну властивостей води у залежності від температури і тиску. Криві на діаграмі поділяють площину між координатними осями на 3 області: нижче від лінії МОК – область існування ненасиченої пари, між лініями ОL і ОK – рідкої води, ліворуч від лінії МОL – льоду. У межах кожної з цих областей можна довільно змінювати тиск і температуру – система при цьому залишиться однофазною. Система за наявності в ній одночасно двох фаз моноваріантна, тобто в ній довільно можна змінювати лише один з параметрів, інший повинен змінюватись у залежності від першого. Лінії ОК і МО – це криві випаровування і возгонки, вздовж яких з підвищенням температури або тиску здійснюються процеси випаровування і возгонки відповідно. У разі зниження температури або тиску вздовж цих кривих відбуваються оборотні процеси конденсації пари, тобто перехід її в рідину або тверду фазу. Лінія ОL – характеризує процеси плавлення льоду та кристалізації рідкої води. Точка О називається нульовою точкою води: за умов, що відповідають цій точці, у рівновазі одночасно знаходяться три фази – рідка вода, лід і водяна пара. Система за цих умов – безваріантна.
Діаграма стану води. Розглянемо діаграму стану однокомпонентної системи на прикладі діаграми стану води (рис. 4.1), яка характеризує зміну властивостей води у залежності від температури і тиску. Криві на діаграмі поділяють площину між координатними осями на 3 області: нижче від лінії МОК – область існування ненасиченої пари, між лініями ОL і ОK – рідкої води, ліворуч від лінії МОL – льоду. У межах кожної з цих областей можна довільно змінювати тиск і температуру – система при цьому залишиться однофазною. Система за наявності в ній одночасно двох фаз моноваріантна, тобто в ній довільно можна змінювати лише один з параметрів, інший повинен змінюватись у залежності від першого. Лінії ОК і МО – це криві випаровування і возгонки, вздовж яких з підвищенням температури або тиску здійснюються процеси випаровування і возгонки відповідно. У разі зниження температури або тиску вздовж цих кривих відбуваються оборотні процеси конденсації пари, тобто перехід її в рідину або тверду фазу. Лінія ОL – характеризує процеси плавлення льоду та кристалізації рідкої води. Точка О називається нульовою точкою води: за умов, що відповідають цій точці, у рівновазі одночасно знаходяться три фази – рідка вода, лід і водяна пара. Система за цих умов – безваріантна.
Рисунок 4.1 – Діаграма стану води
Лекція №5
Термічний аналіз
План лекції
1. Побудова діаграм стану систем за кривими їх охолодження.
2. Діаграми стану систем, компоненти яких утворюють твердий розчин.
3. Діаграми стану систем, компоненти яких утворюють евтектику.
4. Фазові діаграми стану водно-сольових систем. Кріогідрати.
Рекомендована література: [1] С.331-347, [2] С.40-47, [4] С.320-324.
5.1 Побудова діаграм стану систем за кривими їх охолодження
Розділ фізико-хімічного аналізу, що вивчає залежність температур кристалізації або плавлення систем від їх складу називається термічним аналізом. Термічний аналіз ґрунтується на побудові та дослідженні фазових діаграм стану систем. Для побудови діаграм стану застосовують два способи:
· аналіз кривих охолодження, які показують зміну температури суміші з часом;
· фіксування температури, за якої в розплаві з’являються перші кристали.
Так, для побудови діаграм стану двокомпонентних систем беруть дві речовини і готують з них суміші різного складу. Суміші розплавляють, після чого повільно охолоджують і відмічають через певні проміжки часу температуру сплаву. Таким чином одержують криві охолодження. На рис. 5.1 наведено криві охолодження чистої речовини та її сплаву з іншою речовиною.
Т
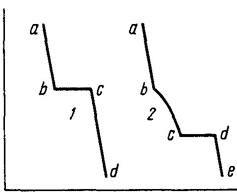 Перехід чистих речовин з рідкого стану в твердий супроводжується виділенням теплоти. Тому, доки вся рідина не кристалізується, її температура залишається сталою (лінія bc на кривій – 1). Під час охолодження розплаву двох речовин спочатку спостерігається рівномірне охолодження рідкого розплаву (лінія ab на кривій – 2), доки з розплаву не починають виділятися кристали однієї з речовин.
Перехід чистих речовин з рідкого стану в твердий супроводжується виділенням теплоти. Тому, доки вся рідина не кристалізується, її температура залишається сталою (лінія bc на кривій – 1). Під час охолодження розплаву двох речовин спочатку спостерігається рівномірне охолодження рідкого розплаву (лінія ab на кривій – 2), доки з розплаву не починають виділятися кристали однієї з речовин.
Рисунок 5.1 – Криві охолодження: 1 – чистої речовини; 2 – сплаву двох речовин
Якщо температури кристалізації речовин відрізняються, то виділення кристалів з їх розплаву починається в інтервалі між температурами кристалізації чистих речовин. Під час виділення кристалів однієї з речовин склад розплаву змінюється, що призводить до зниження температури його кристалізації (лінія – bс на кривій – 2). Коли розплав стає насиченим відносно обох речовин починається одночасна кристалізація обох речовин (точка – с). Це відповідає появі горизонтальної ділянки – сd. Після закінчення процесу кристалізації починається охолодження вже твердого сплаву, яке характеризується лінією dе.
5.2 Діаграми стану систем, компоненти яких утворюють твердий розчин
Тверді розчини – це гомогенні системи, які перебувають у твердому стані. Вони утворюються, якщо компоненти системи – ізоморфні, тобто мають близьку за своїми параметрами структуру. Тверді розчини бувають двох типів: заміщення або включення. Тверді розчини включення утворюють елементи, атоми яких мають малий діаметр (Ве, В, С). Атоми розташовуються в пустотах між вузлами кристалічних ґраток металу-розчиннику. У твердих розчинах заміщення атоми однієї речовини заміщують у вузлах кристалічних ґраток атоми іншої речовини. Температури плавлення і кристалізації у таких системах співпадають тільки для чистих речовин. Температура плавлення твердого розчину і температура кристалізації розплаву однакових складів відрізняються. На рис. 5.2 приведена фазова діаграма стану системи, компоненти якої А і В утворюють твердий розчин. На осі ординат відкладається температура системи, на осі абсцис – склад системи, тобто мольна частка компоненту В – ХВ.
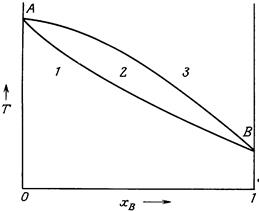 Верхня лінія кривої АВ, що характеризує залежність температури кристалізації розплаву від його складу, називається лінією ліквідусу. Вище неї на діаграмі розташована область розплаву.Нижня крива АВ, що характеризує залежність температури плавлення твердого розчину від його складу, називається лінією солідусу. Нижче неї розташована область гомогенного твердого розчину. Криві ліквідусу і солідусу сходяться у точках А і В, що є температурами плавлення компонентів. Область, що міститься між лініями солідусу і ліквідусу, відповідає співіснуванню двох фаз – кристалів твердого розчину і рідкого розплаву. Для діаграм стану ізоморфних речовин характерним є плавний характер кривих ліквідусу та солідуса в межах усієї діаграми. Лінії, що з’єднують точки на ліквідусі і солідусі за сталої температури, називаються нодами. Точки перетину ноди з ліквідусом і солідусом характеризують склад розплаву і твердого розчину.
Верхня лінія кривої АВ, що характеризує залежність температури кристалізації розплаву від його складу, називається лінією ліквідусу. Вище неї на діаграмі розташована область розплаву.Нижня крива АВ, що характеризує залежність температури плавлення твердого розчину від його складу, називається лінією солідусу. Нижче неї розташована область гомогенного твердого розчину. Криві ліквідусу і солідусу сходяться у точках А і В, що є температурами плавлення компонентів. Область, що міститься між лініями солідусу і ліквідусу, відповідає співіснуванню двох фаз – кристалів твердого розчину і рідкого розплаву. Для діаграм стану ізоморфних речовин характерним є плавний характер кривих ліквідусу та солідуса в межах усієї діаграми. Лінії, що з’єднують точки на ліквідусі і солідусі за сталої температури, називаються нодами. Точки перетину ноди з ліквідусом і солідусом характеризують склад розплаву і твердого розчину.
Рисунок 5.2 – Діаграма стану системи, компоненти якої утворюють твердий розчин: 1 – гомогенний твердий розчин; 2 – рідкий розплав+кристали твердого розчину; 3 – рідкий розплав
5.3 Діаграми системи, компоненти якої утворюють евтектику
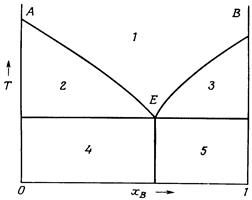 Речовини, що погано розчиняються одна в одній у твердому стані, під час кристалізації їх розплавів часто утворюють суміш дрібних кристалів, яку називають евтектикою. Евтектика характеризується більш низькою температурою плавлення, ніж температури плавлення компонентів, які її утворили. На рис. 5.3. приведена діаграма плавкості такої системи. Точка Е на діаграмі характеризує склад евтектики і називається евтектичною точкою.
Речовини, що погано розчиняються одна в одній у твердому стані, під час кристалізації їх розплавів часто утворюють суміш дрібних кристалів, яку називають евтектикою. Евтектика характеризується більш низькою температурою плавлення, ніж температури плавлення компонентів, які її утворили. На рис. 5.3. приведена діаграма плавкості такої системи. Точка Е на діаграмі характеризує склад евтектики і називається евтектичною точкою.
Рисунок 5.3 – Діаграма стану системи з простою евтектикою: 1 – гомогенний розплав речовин А і В; 2 – рідкий розплав + кристали В; 3 – рідкий розплав + кристали А; 4 – евтектика + кристали А; 5 – евтектика + кристали В
5.3 Фазові діаграми стану водно-сольових систем
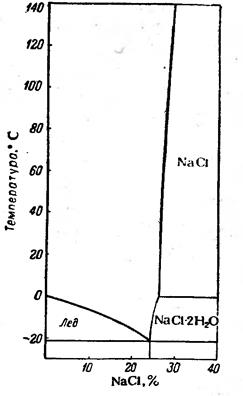 Водні розчини багатьох солей під час замерзання утворюють евтектичні суміші, які називають кріогідратами. Під час кристалізації евтектик кожний з компонентів виділяється окремо, тому затверділа евтектика є двофазною системою. Кріогідрати – дуже дрібні суміші кристаликів солі і льоду.
Водні розчини багатьох солей під час замерзання утворюють евтектичні суміші, які називають кріогідратами. Під час кристалізації евтектик кожний з компонентів виділяється окремо, тому затверділа евтектика є двофазною системою. Кріогідрати – дуже дрібні суміші кристаликів солі і льоду.
На рис. 5.4 наведено діаграму стану водно-сольової системи NaCl – H2O. Евтектична суміш містить 24,4 % NaCl, а температура її замерзання становить –21,20С. Температура плавлення солі набагато вища за температуру танення льоду. Тому на діаграмі права частина гілки ліквідусу, яка характеризує температуру плавлення солі, на практиці не реалізується. Додатковою фазою на діаграмі є кристалогідрат – NaCl×2H2O, який існує за температур нижче 00С і за концентрацій солі в системі більших ніж її вміст в евтектиці.
Рисунок 5.4 – Діаграма стану системи NaCl – H2O
Кріогідрати застосовують для виготовлення охолоджувальних сумішей – систем з великою теплоємністю і низькою температурою замерзання. Суміші зручні тим, що охолоджені до певної температури вони здатні самочинно підтримувати цю температуру, доки в системі є нерозплавлений лід або дрібні кристали солі. Поступово танучи лід віднімає з навколишнього середовища теплоту, а сіль, розчиняючись у воді, що утворилася з льоду, підтримує в рідкій фазі концентрацію солі, яка відповідає складу евтектики. У табл. 5.1 наведено склад найбільш розповсюджених кріогідратних сумішей.
Таблиця 5.1 – Приблизний склад холодильних водно-сольових сумішей
| Сіль | Маса солі на 100 г води, г | Температура, 0С |
| Натрій ацетат, CH3COONa | – 4,70 | |
| Амоній хлорид, NH4Cl | – 5,10 | |
| Натрій нітрит, NaNO2 | – 13,5 | |
| Натрій хлорид, NaCl | – 21,0 | |
| Кальцій хлорид, CaCl2 | – 55,0 |
На лекції надаються приклади визначення температур початку і кінця кристалізації двокомпонентних систем, що утворюють твердий розчин або евтектику, а також приклади розрахунків складу і масу твердої та рідкої частин сплаву в таких системах за допомогою "правила важеля".
ЗНОШУВАННЯ І РУЙНУВАННЯ РІЗАЛЬНОГО ІНСТРУМЕНТУ.
11.1 Зношування різального інструменту
11.1.1 Зношування як руйнування контактних площадок робочої частини інструменту. Види зношування
В процесі різання металів внаслідок тертя стружки по передній поверхні леза і задніх поверхонь леза по поверхні заготовки відбувається зношування різця, яке проходить в вигляді стирання і видалення мікрочасток поверхонь, а також в вигляді мікросколювань (викришувань) різальної кромки. Знос інструментальних матеріалів відбувається і в вигляді пластичного деформування під дією сил різання частини матеріалу, яка утворює різальну кромку.
Тертя і пов’язаний з ним знос при різанні металів відрізняється від загального тертя поверхонь деталей машин. Під час різання виникає тертя між поверхнями, які постійно знову утворюються (оновлюються). Це тертя протікає при високих температурах, високих тисках і на відносно невеликих поверхнях контакту.
З фізичної сторони процес зношування інструмента є дуже складним.
Розрізняють наступні різновиди зносу: абразивний, адгезійний (молекулярний), дифузійний і окислювальний.
Абразивний знос виникає внаслідок дряпання-зрізання мікроскопічних об’ємів матеріалу інструменту твердими структурними складовими оброблюваного металу (карбіди, частки наросту, який руйнується і переноситься стружкою, ливарна корка і окалина на заготовках).
Адгезійний (молекулярний) знос виникає внаслідок дії значних сил молекулярного зчіплювання (налипання, зварювання) між матеріалом заготовки (стружки) та інструменту, що викликає при ковзанні відрив найдрібніших часток матеріалу інструменту.
Дифузійний знос виникає внаслідок взаємного розчинення реагуючих пар оброблюваного металу і матеріалу інструменту.
Окислювальний знос виникає як результат хімічної реакції кисню повітря з кобальтовою фазою твердого сплаву та карбідами вольфраму і титану при температурі різання 700-800°С, при цьому найбільш сильно окислюється кобальт. Твердість продуктів окислення в 40-60 разів нижча твердості твердих сплавів. Внаслідок розм’якшування кобальтової фази порушується монолітність сплаву і послаблюється зв’язок між зернами карбідів. Це утворює умови для виривання карбідних зерен силами тертя, що діють на контактних поверхнях заготовки і інструменту, і для їх зношування.
В реальних умовах оброблення можуть мати місце всі види зносу з переважним впливом одного з них в залежності від умов різання: фізико-механічних властивостей оброблюваного металу і матеріалу інструмента, виду і фізико-хімічних властивостей МОР, елементів режиму різання (рис. 11.1) та геометрії робочої частини інструменту, жорсткості системи ВПІД і таке інше.
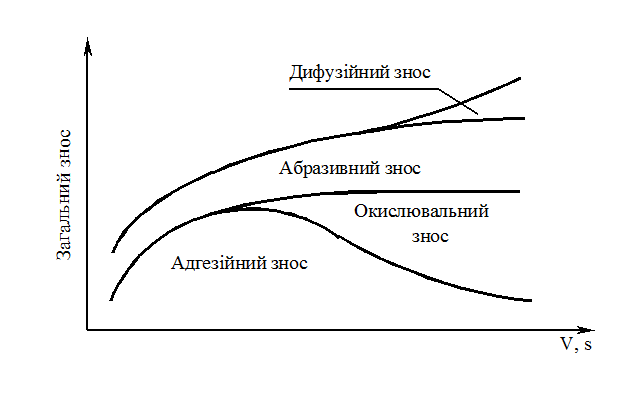
Рисунок 11.1 – Вплив швидкості різання та подачі на види зношування
11.1.2 Зовнішня картина зношування інструменту
В загальному випадку різець зношується по передній і задній поверхням, але в залежності від умов оброблення може переважати той чи інший із вказаних видів зношувань (рис. 11.2 а, б, в).
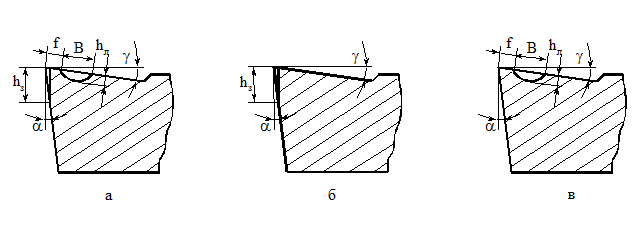
Рисунок 11.2 – Зовнішня картина зношування поверхонь леза інструменту
а – зношування по передній та задній поверхнях леза;
б – зношування по задній поверхні леза;
в – зношування по передній поверхні леза
Зношування по задній поверхні характеризується висотою площадки hз, по передній поверхні – глибиною hл і шириною лунки B, довжина лунки змінюється незначно.
В процесі роботи знос інструменту як по передній, так і по задній поверхням збільшується, зменшуючи площадку f. Коли ширина лунки B буде такою, що вона досягне різальної кромки, остання зруйнується і різець вийде із ладу. Щоб різець міг знову різати, його необхідно заточити, вилучивши при цьому певний шар по передній і задній поверхням леза.
У різців, які мають радіус округлення при вершині, зношування по задній поверхні вздовж активної частини різальної кромки розповсюджується нерівномірно. Найбільша величина зносу різця при роботі не по корці має місце біля вершини, тому що вершина знаходиться в найбільш важких температурних умовах внаслідок притоку теплоти з боку допоміжної різальної кромки. Крім того кут α на округленій ділянці є перемінним і меншим від кута біля прямолінійної кромки.
У відрізних і прорізних різців найбільш напруженим буде місце переходу від головної різальної кромки до допоміжної, де зношування по задній поверхні буде декілька більшим в порівнянні з іншими ділянками різальної кромки.
Зношування твердосплавних різців може супроводжуватись осипанням і викришуванням вершини леза. Під осипанням розуміють часткове або суцільне руйнування леза розміром, який не перебільшує 0,3 мм. Під викришуванням розуміють часткове або суцільне руйнування лез і поверхонь інструменту розміром від 0,3 до 1 мм. Більш значні ушкодження лез (сколювання) відносяться до контактного руйнування різальної частини інструменту.
При різанні інструментами із твердих сплавів з дуже значними силовим і тепловим навантаженнями перед зношуванням інструмента інколи спостерігається пластичне деформування леза (рис. 11.3). Зміна форми леза полягає в пониженні частини передньої поверхні інструменту, яка прилягає до головної різальної кромки. Внаслідок скривлення задньої поверхні на ній утворюється нульовий або негативний задній кут, який сприяє інтенсивному зношуванню інструмента.
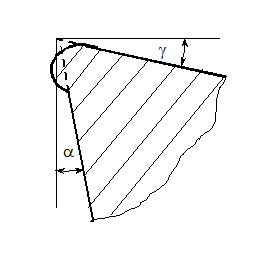
Рисунок 11.3 – Пластичне деформування леза інструменту
11.1.3 Методи вимірювання величини зношування. Крива зносу різців
Зношування по задній поверхні hз можна виміряти за допомогою звичайної лупи з 20-кратним збільшенням, а глибину лунки – за допомогою індикатора (лінійний метод).
Сумарний знос по задній і передній поверхнях можна визначити зважуванням на аналітичних терезах інструменту до і після досліду (метод зважування). Сумарний знос інструменту можна визначити також і за допомогою метода радіоактивних ізотопів. Його сутність полягає в утворенні в інструменті радіоактивних ізотопів шляхом опромінення його ядерними частинками, які в вигляді продуктів зношування будуть виноситись стружкою. По радіоактивності стружки за допомогою спеціального лічильника і визначається величина сумарного зносу.
Залежність величини зносу інструмента від часу оброблення описується кривою, яку можна розділити на три ділянки (рис. 11.4):
I – період припрацювання, в якому проходить стирання найбільш виступаючих часток поверхні; чим менший параметр шорсткості будуть мати поверхні тертя, тим менш різко збільшується знос в один і той же час;
II – період нормального зношування; він характеризується тим, що знос поступово збільшується з часом роботи;
III – період підвищеного (катастрофічного) зносу; характеризується різким зростанням зносу за рахунок зміни умов тертя і сильного підвищення температури різання.
Об’єктивним кількісним показником зношування інструмента є інтенсивність наростання зносу, яка вимірюється в міліграмах на 1 м робочого шляху різальної кромки dM/dL. Використовуючи поняття інтенсивності зношування dM/dL, можна порівнювати зносостійкість різних інструментальних матеріалів і судити про вплив на стійкість інструмента його геометричних параметрів та факторів режиму різання.
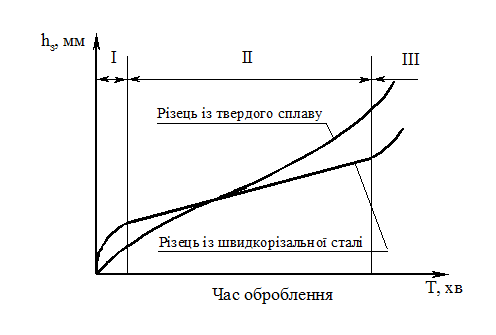
Рисунок 11.4 – Крива зношування різців
Дата добавления: 2015-04-03; просмотров: 2664;
