Насыщаемость ковалентной связи
Насыщаемость ковалентной связи (валентные возможности атома, максимальная валентность) характеризует способность атомов участвовать в образовании определенного ограниченного числа ковалентных связей и определяет стехиометрический состав молекул. Насыщаемость – особенность образования ковалентных связей прежде всего по обменному механизму. Это означает, что если атом имеет некоторое количество неспаренных электронов в нормальном или возбужденном состоянии, то все они участвуют в образовании химических связей. Например, атом азота имеет 3 неспаренных электрона, а водород – 1. Принцип насыщаемости указывает на то, что устойчивым соединением должно быть NH3, а не NH2, NH или NH4.
Валентность.Валентность элемента (В) - его способность к образованию химических связей. В представлении МВС численное значение валентности соответствует числу ковалентных связей, которые образует атом.
Согласно обменному механизму метода ВС каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода ВС считают число неспаренных электронов у атома в основном или возбужденном состоянии атома. Это неспаренные электроны внешних оболочек у s- и р – элементов, внешних и предвнешних оболочек у d – элементов, предвнешних и предпредвнешних оболочек у f – элементов.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары (или пар) электронов и переходе одного электрона (или нескольких электронов, равных числу разъединенных пар) в свободную орбиталь (орбитали) того же энергетического уровня. Перевод электрона с одного подуровня на другой осуществляется за счет энергии, получаемой извне. Эти затраты компенсируются энергией, выделяемой при образовании связей. В результате этого число неспаренных электронов в атоме и его валентность увеличиваются.
Например, валентность элементов главной подгруппы I группы равна единице, так как на внешнем уровне атомы этих элементов имеют один электрон:
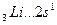
 B=1
B=1
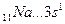
 B=1
B=1
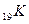 и т. д.
и т. д.
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем уровне нет неспаренных электронов:
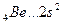



 В=0.
В=0.
2s 2p
Однако в соединениях он проявляет валентность, равную 2. Это объясняется тем, что, вступая в химическое соединение, атом бериллия переходит в возбужденное состояние 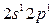 , т. е. спаренные s – электроны разъединяются в свободные ячейки р – подуровня этого же уровня. Валентность становится равной двум (возбужденный атом отмечен звездочкой):
, т. е. спаренные s – электроны разъединяются в свободные ячейки р – подуровня этого же уровня. Валентность становится равной двум (возбужденный атом отмечен звездочкой):
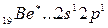



 В*=2
В*=2
2s 2p
Энергия возбуждения бериллия из состояния 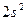 в состояние
в состояние 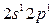 составляет 62 ккал/моль атомов. При образовании одной химической связи происходит выделение энергии от 50 до 100 ккал. Таким образом, при образовании двух химических связей энергии выделяется гораздо больше, чем её затрачивается на возбуждение.
составляет 62 ккал/моль атомов. При образовании одной химической связи происходит выделение энергии от 50 до 100 ккал. Таким образом, при образовании двух химических связей энергии выделяется гораздо больше, чем её затрачивается на возбуждение.
Аналогично, элементы главных подгрупп III и IV групп в основном состоянии имеют В=1 и В=2, в возбужденном - В*=3 и В*=4, соответственно; например:
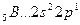



 В=1
В=1
2s 2p
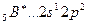



 B*=3
B*=3
2s 2p
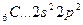



 В=2
В=2
2s 2p
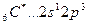



 B*=4.
B*=4.
2s 2p
Возбуждение азота, кислорода и фтора в пределах второго квантового уровня не может привести к увеличению числа неспаренных электронов из-за отсутствия свободных атомных орбиталей во втором уровне:
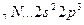



 B=3
B=3
2s 2p

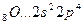


 B=2
B=2
2s 2p
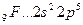



 B=1.
B=1.
2s 2p
Возбуждение электронов в этих атомах, связанное с их перемещением на следующий квантовый уровень, требует значительно большей энергии, чем та, которая выделится при образовании дополнительных связей.
В то же время элементы третьего периода – фосфор, сера и хлор могут проявлять переменную валентность, в т. ч. и соответствующую номеру группы периодической системы. Рассмотрим серу – аналог кислорода:
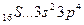
 B=2.
B=2.
3s 3p 3d
При возбуждении распариваются р - электроны, s – электроны с переходом на свободные d – орбитали третьего энергетического уровня. В состоянии 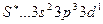
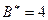 , в состоянии
, в состоянии 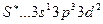
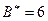 . Соответственно сера, кроме валентности основного состояния 2, имеет валентность 4 и 6 в возбужденном состоянии, а хлор, кроме валентности 1 в основном состоянии, имеет валентности 3, 5 и 7 в возбужденном состоянии.
. Соответственно сера, кроме валентности основного состояния 2, имеет валентность 4 и 6 в возбужденном состоянии, а хлор, кроме валентности 1 в основном состоянии, имеет валентности 3, 5 и 7 в возбужденном состоянии.
За счет внешних s – и р – орбиталей атомы не могут иметь валентность, превышающую 4, поскольку при образовании четырёх связей атом окружён восемью электронами. Валентность выше четырёх может проявляться только при участии d – или f – орбиталей. Следовательно, возникновение устойчивого валентного состояния атома выше четырёх можно ожидать только для элементов, начиная с IV периода периодической системы.
Особенно большие возможности для проявления различных валентностей имеются у переходных элементов. Близость по энергиям ns-, np– и (n - 1)d – орбиталей делает принципиально возможным участие всех девяти орбиталей (s1p3d5) в образовании химических связей. Так, в соединении ReO3F рений семивалентен, а рутений в соединении RuO4 восьмивалентен.
Следует отметить, что у атомов большинства d- и f – элементов на внешних оболочках в основном состоянии нет неспаренных электронов, поэтому их валентность в основном состоянии равна нулю, несмотря на то, что на предвнешних d – и f – подоболочках имеются неспаренные электроны. Последние не могут образовывать электронные пары с электронами других атомов, так как закрыты электронами внешней оболочки. При возбуждении атома распаренные электроны внешней оболочки вступают в химическую связь и открывают внутренние электронные оболочки. Например, валентность железа в основном состоянии равна нулю:
26Fe 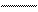
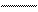
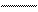
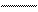
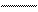
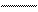


 B=0
B=0
3d 4s 4p
В возбужденном состоянии происходит разъединение 4s – пары электронов:
26Fe* 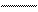
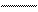
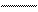
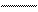
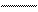
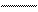
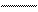

 B*=6
B*=6
3d 4s 4p
Валентность железа в возбужденном состоянии определяется не только 4s - , 4p - , но и 3d – неспаренными электронами. Пара 3d – электронов не может разъединяться, потому что в третьей оболочке нет вакантных орбиталей, поэтому максимальная валентность железа равна шести.
У осмия при возбуждении могут разъединяться не только внешние 6s – электроны, но и предвнешние 5d – электроны, поскольку в пятой оболочке имеется еще 5f – подоболочка со свободными орбиталями, поэтому максимальная валентность осмия равна восьми:
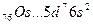
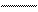
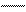
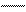
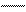
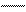







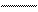


 В=0
В=0
5d 5f 6s 6p
76Os* 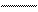
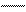
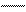
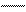
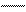
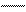






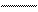
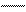

 B*=8
B*=8
5d 5f 6s 6p
Таким образом, одни атомы проявляют постоянную валентность, тогда как другие – переменную. Постоянную валентность проявляют s – элементы, а переменную – р- и d- элементы(исключение составляют N, O, F; они в пределах 2-го энергетического уровня не имеют свободных атомных орбиталей). Низшая валентность проявляется в невозбужденном состоянии, высшая – в наиболее возбужденном. Для большинства атомов высшая валентность равна номеру группы.
За счет донорно – акцепторного механизма увеличиваются валентные возможности атомов (за счет наличия вакантных орбиталей и неподеленных электронных пар). Так, в рассмотренном в разделе 3.3 примере атом азота в ионе NH4+ (аммония) имеет валентность, равную четырем.
Таким образом, суммарная валентность элемента равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных по донорно-акцепторному механизму
Дата добавления: 2015-04-19; просмотров: 868;
