Молекулярні спектри
На відміну від енергії атомів, енергія молекули визначається не тільки енергетичним станом електронної оболонки, а й коливальною енергією ядер атомів, що входять до складу молекули, а також енергією обертання ядер навколо загального центра мас. Взагалі, ці три види енергії взаємопов'язані, але в достатньому наближенні можна знехтувати їх взаємним впливом. Тоді повна енергія молекули може бути подана у вигляді суми електронної, коливальної та обертальної енергій:
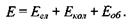
Кожний з цих видів енергії підпорядковується квантовим законам, тобто може приймати жорстко визначені значення. В результаті цього частота світла, що випромінюється або поглинається при зміні енергетичного стану молекули, визначається рівністю:
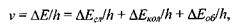 (7.15)
(7.15)
завдяки чому спектр молекули містить окремі, близько розташовані лінії, що складають смуги.
Теорія та експеримент показує, що найбільше значення набувають різниці електронних енергій, а найменше - різниці обертальних енергій, тобто
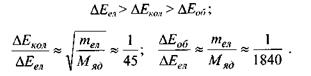
Розглянемо структуру енергетичних рівнів молекули (рис.7.2).
Електронна оболонка молекули, як і атома, може знаходитись в різних енергетичних станах. Нехай рівні відповідають основній та збудженій електронним конфігураціям. Кожній з цих електронних конфігурацій відповідають свої коливання ядер, в результаті чого ми одержимо два набори коливальних рівнів для основної та збудженої електронних конфігурацій. Завдяки обертанню молекули кожний коливальний рівень розпадається на ряд обертальних підрівнів.
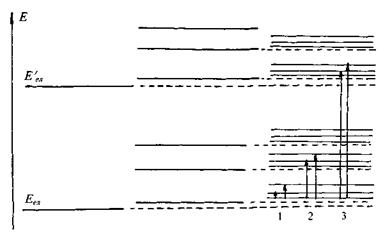
Рис. 7.2. Структура енергетичних рівнів молекули.
Молекулярні спектри займають широкий діапазон електромагнітного випромінювання.
Нехай збудження молекули незначне, так що
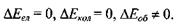
У цьому випадку спостерігаємо переходи між обертальними підрівнями в межах одного коливального рівня (рис.7.2). Частоти, що випромінюються (поглинаються) при таких переходах, утворюють обертальний спектр, що складається з окремих ліній, розташованих в далекій інфрачервоній та мікрохвильовій областях 
Нехай збудження молекули спричинює до зміни коливальної енергії ядер, тобто:
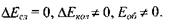
У цьому випадку виникає коливально-обертальний спектр, який розташований в ближній інфрачервоній області. Він складається зі смуг, які розпадаються на окремі лінії, що зумовлені переходами між обертальними підрівнями у межах одного и того самого електронного рівня (рис. 7.2, 2).
При значному збудженні молекули

Електронно-коливально-обертальний спектр, що спостерігається при цьому, лежить у видимій та ультрафіолетовій областях. Він складається зі смуг, утворених окремим лініями, що відповідають переходам між обертальними підрівнями різних електронних конфігурацій (рис.7.2, 3).
Спектри поглинання (абсорбції) та випромінювання (емісії) даного сорту молекул жорстко індивідуальні та специфічні, що дають змогу використовувати їх для проведення якісного та кількісного аналізів. Особливо важливим джерелом інформації про будову органічних молекул та характер міжмолекулярних взаємодій є абсорбційні коливальні та електронні спектри. Завдяки встановленій відповідності між частотами, що спостреріга-ються, та коливаннями різних груп атомів в молекулі стало можливим по коливальному спектру визначати присутність у молекулі окремих груп атомів та зв'язків, тобто визначати склад молекули. Для ідентифікації речовин, визначення їх концентрації, структурних параметрів макромолекул та їх оточення вимірюється ступінь поглинання світла. Поглинання світла проявляється в послабленні світлового потоку, що пройшов досліджуваний зразок (розчин або речовину). Воно буде тим більше, чим більша концентрація С досліджуваної речовини в розчині, товщина кювети з розчином  та здатність речовини до поглинання, що характеризується коефіцієнтом
та здатність речовини до поглинання, що характеризується коефіцієнтом 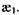 Ці закономірності відображені в законі Бугера-Ламберта-Бера
Ці закономірності відображені в законі Бугера-Ламберта-Бера
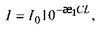
який можна подати у такому вигляді:
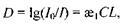
де 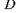 - оптична густина зразка;
- оптична густина зразка; 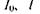 - інтенсивності падаючого світла та світла, що пройшло речовину, відповідно;
- інтенсивності падаючого світла та світла, що пройшло речовину, відповідно;  - коефіцієнт поглинання.
- коефіцієнт поглинання.
Дослідження поглинання світла різними речовинами здійснюють за допомогою спектрофотометрів. Принципову схему спектрофотометра подано нарис. 7.3.
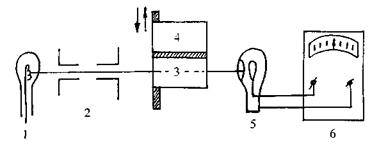
Рис. 7.3. Принципова схема спектрофотометра.
Світло від джерела випромінювання 1 проходить через монохроматор 2 для виділення складової з певною довжиною хвилі. Розчин досліджуваної речовини та чистий розчинник знаходяться в двох кюветах 3 та 4, розміщених в спеціальних держаках. Світло проходить через кювету і падає на фотоелемент 5, вихідний сигнал якого реєструється вимірювальним приладом 6.

Рис. 7.4 Спектри поглинання у вигляді залежностей
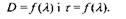
Принцип роботи спектрофотометра полягає у вимірюванні інтенсивностей світла, що пройшло через розчинник, а також через розчин речовини у тому самому розчиннику. Різниця цих інтенсивностей дає змогу зробити висновок про ступінь поглинання світла розчиненою речовиною. Для одержання спектра ця операція повторюється для багатьох довжин хвиль. Спектр подають у вигляді залежностей 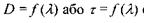 (рис. 7.4 а, б), де
(рис. 7.4 а, б), де  - коефіцієнт пропускання.
- коефіцієнт пропускання.
7.3. ЕЛЕКТРОННИЙ ПАРАМАГНІТНИЙ РЕЗОНАНС,
Дата добавления: 2015-03-03; просмотров: 1533;
