Физические повреждающие факторы
Среди физических причин наиболее часто вызывают повреждение клеток и тканей механические воздействия (ранения), температурные влияния (ожоги) и облучение.
При ранениях происходит дезорганизация тканей, клеток и субклеточных структур. Степень травмы зависит от силы повреждающего воздействия, его длительности, а также площади повреждения.
Вокруг зоны ранения, состоящей из погибших клеток (зона некроза), немедленно образуется вторая зона, характеризующаяся высокой ферментативной активностью. Ферменты этой зоны, преимущественно гидролазы лизосом нейтрофильных лейкоцитов (микрофагов) и моноцитов (макрофагов) расщепляют макромолекулы погибших клеток. Этим расчищается место для вновь образующихся клеток, а мономеры, появляющиеся при расщеплении макромолекул, служат строительным материалом для этих клеток. У неповрежденных клеток этой ткани (эпителиальной), находящихся на границе травмы, резко возрастает митотическая активность. Это происходит под влиянием биологически активного полипептида - эпидермального фактора роста (ЭФР), который образуется в очаге повреждения. Процесс заживления начинается уже в самый момент нанесения травмы без всякого переходного периода. При обширных ранениях, особенно сопровождающихся размозжением тканей, в зоне некроза накапливается большое количество продуктов лизиса (гидролиза) тканей, а также недоокисленных продуктов обмена. Эти вещества служат благоприятной средой для развития микроорганизмов, а также раздражают нервные окончания, вызывая интенсивный поток болевых импульсов в центральную нервную систему. Интоксикация продуктами деструкции собственных тканей и чрезмерная болевая импульсация могут привести к развитию шока. Шок характеризуется резким снижением всех функций организма, обусловленным угнетением (вслед за первоначальным возбуждением) нервной системы, расстройством кровообращения, обмена веществ и дыхания. Различают первичный (после ранения) травматический шок и вторичный, который развивается спустя несколько часов после травмы. Вторичный травматический шок обусловлен, главным образом, аутоинтоксикацией продуктами разрушения тканей. Лечебные мероприятия при травме состоят из хирургической обработки раны, иммобилизации (создании покоя) повреждённой части тела, введения антибактериальных и анальгетических (обезболивающих) препаратов.
Термические воздействия (ожоги) вызывают прежде всего структурные изменения в белковых молекулах клеток. Эти изменения в зависимости от величины и длительности температурного воздействия, колеблются от обратимой денатурации (потери молекулой белка четвертичной, третичной и вторичной структуры) до необратимой минерализации (обугливания). Степень ожога зависит от температуры источника, экспозиции (длительности воздействия) и площади повреждения. Температурному воздействию в первую очередь подвергаются эпителиальные клетки, лежащие под роговым слоем кожи. Высоко чувствительны к температурному воздействию клетки эндотелия микрососудов. При температурном воздействии легко травмируются капилляры, существенно повышается проницаемость капилляров для плазмы крови, которая скапливается в межклеточном пространстве, обусловливая развитие отёка. Отёчная жидкость, сочащаяся по ожоговой поверхности, является прекрасной питательной средой для микроорганизмов. Так создаётся предпосылка для внедрения инфекции и распространения инфекционного процесса по всему организму (сепсису), что является грозным осложнением ожогов. При ожогах резко возрастает теплопродукция. Эта мера направлена на компенсацию потерь тепла, которые значительно повышаются при нарушении теплоизолирующего слоя и усилении испарения воды с ожоговой поверхности. Интенсификация теплопродукции осуществляется под влиянием гормона адреналина, который при обширных травмах вследствие боли и страха выделяется в больших количествах в кровь. В первые часы после ожога усиление теплопродукции обеспечивается за счёт активации окисления глюкозы, мобилизующейся из запасов гликогена в печени. В дальнейшем энергообразование покрывается за счёт расщепления жира в жировых клетках (адипозоцитах). Интенсивное окисление жиров и жирных кислот обусловливает накопление недоокисленных продуктов обмена и развитие метаболического (обменного) ацидоза (сдвига рН в кислую сторону). Все рассмотренные явления - боль, страх, потеря жидкости (сгущение крови), ацидоз, аутоинтоксикация продуктами распада собственных тканей являются компонентами патогенеза ожогового шока. Общие меры при лечении ожогов направлены на уменьшение и восполнение потерь белка, солей и воды, а также на нормализацию рН крови. Важно устранить боль и свести к минимуму неадекватно сильное и поэтому пагубное влияние адреналина. С целью профилактики инфицирования необходимо обрабатывать ожоговую поверхность (подсушивание в стерильных условиях, наложение стерильных повязок, пропитанных растворами антибиотиков и местных анестетиков).
Накопленные запасы и испытания ядерного оружия, широкое использование энергии атома в мирных целях увеличили значимость в современной медицине радиационного поражения организма.
При действии проникающей радиации повреждается ДНК. Она деспирализуется, её азотистые основания могут заменяться на другие или выпадать (точечные мутации). Тормозится синтез ДНК, деление клеток, нарушается их рост и дифференциация. При необратимых изменениях молекула ДНК гибнет. Действие ионизирующей радиации не ограничивается повреждением ДНК. Энергия излучения поглощается всеми структурами клетки, при этом из воды образуются свободные радикалы, которые вызывают перекисное окисление липидов мембран клеток и разрушают их. В таблице 3.1. показаны этапы свободнорадикального перекисного окисления липидов и пути антиоксидантной защиты клеток.
Таблица. 3.1
Этапы свободнорадикального перекисного окисления липидов (СПОЛ) и пути антиоксидантной защиты клеток
| Этапы СПОЛ | Пути антиоксидантной защиты |
| Кислородная инициация СПОЛ | Антикислородное действие Строение неповрежденной клеточной мембраны создает пространственное затруднение для проникновения кислорода в липидный слой мембран Уменьшение содержания О2 в цитоплазме клетки обеспечивается возрастающей утилизацией О2 в митохондриях |
| Образование свободных радикалов липидов | Антирадикальное действие
Супероксиддисмутаза катализирует взаимодействие супероксидных радикалов кислорода (дисмутации) 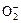 .
Серосодержащие аминокислоты (метионин, цистеин) акцептируют супероксидные радикалы и препятствуют образованию Н2О2
Экзогенные вещества - феруловая кислота, аскорбиновая кислота - представляют собой «ловушки» перекисных радикалов, они реагируют со свободными радикалами, обрывая цепь последующих реакций СПОЛ .
Серосодержащие аминокислоты (метионин, цистеин) акцептируют супероксидные радикалы и препятствуют образованию Н2О2
Экзогенные вещества - феруловая кислота, аскорбиновая кислота - представляют собой «ловушки» перекисных радикалов, они реагируют со свободными радикалами, обрывая цепь последующих реакций СПОЛ
|
| Образование перекисей липидов | Антиперекисное действие Глютатионпероксидаза, каталаза. Инактивация гидроперекисей липидов и пероксида водорода (Н2О2) |
Свободные радикалы не только разрушают мембраны клеток, они подавляют активность восстановительных ферментов клетки (содержащих сульфгидрильные группы -SH). Благодаря этому окислительный потенциал клетки возрастает, ряд субстратов подвергается свободнорадикальному окислению и образуются первичные радиотоксины. Из фенолов образуются хиноны и семихиноны, из ненасыщенных жирных кислот мембран клеток и субклеточных структур - перекиси, эпоксиды и кетоны жирных кислот. Хиноны и семихиноны угнетают синтез ДНК, подавляют деление, рост и развитие клеток, а также вызывают в ядрах мутации. Липидные радиотоксины окисляют SH-группы ферментов, повреждают мембраны митохондрий и лизосом, угнетают образование АТФ. На более поздних этапах формирования лучевой болезни образуются вторичные радиотоксины - гистамин, продукты распада белков и др., которые усугубляют повреждение клеток организма. Они образуются в результате повреждающего действия первичных радиотоксинов.
Прежде всего гибнут клетки, характеризующиеся ускоренным метаболизмом: клетки кроветворных органов, селезёнки, волосяных луковиц, слизистой пищеварительного канала.
Степень радиационного поражения зависит от вида излучения, дозы и длительности его воздействия. Максимальное кратковременное однократное облучение человека в дозе 200 рад. переносится большинством людей без тяжёлых последствий. Превышение этой дозы или длительное облучение меньшими дозами, но превышающими в совокупности этот порог, приводит к развитию лучевой болезни. При остром и, особенно, хроническом лучевом поражении возникают отдалённые последствия, проявляющиеся в виде дефектов иммунной системы: часто возникают и тяжело протекают инфекционные болезни, чаще развиваются злокачественные опухоли, наблюдается преждевременное старение и сокращение продолжительности жизни. Повреждение генеративных клеток мужчин и, особенно, женщин представляет большую опасность, т.к. может привести к появлению генетических дефектов у потомства.
Успехи медикаментозного лечения лучевой болезни и её последствий пока невелики. Применяют антиоксиданты, средства, подавляющие активность обменных процессов и вещества, блокирующие действие радиотоксинов. Однако, защитный эффект этих веществ имеет место .лишь при профилактическом введении. Наиболее эффективным средством лечения лучевой болезни в настоящее время является пересадка костного мозга.
Дата добавления: 2015-02-23; просмотров: 1310;
