Т е о р и я м е т о д а. Изменение состояния идеального газа связано с изменением его параметров
Изменение состояния идеального газа связано с изменением его параметров. Согласно 1 закона термодинамики, количество теплоты 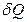 , сообщенное системе, идет на увеличение внутренней энергии системы
, сообщенное системе, идет на увеличение внутренней энергии системы 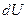 и на совершение термодинамической работы
и на совершение термодинамической работы 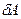
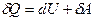 (1)
(1)
Количество теплоты, необходимое для нагревания единицы массы вещества на один градус, называется удельной теплоемкостью:
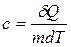 (2)
(2)
Удельная теплоемкость газа зависит от условий, при которых происходит нагревание. Различают теплоемкости (удельную и молярную) при постоянном давлении (cp и 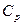 ) и при постоянном объеме (cv и
) и при постоянном объеме (cv и 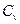 ). Для жидких и твердых тел, объем которых мало изменяется по сравнению с газом, значения
). Для жидких и твердых тел, объем которых мало изменяется по сравнению с газом, значения 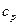 и
и 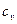 близки друг к другу по величине. Для разного рода практических расчетов их можно считать одинаковым. Сообщенное при постоянном давлении тепло идет на совершение работы и на изменение внутренней энергии, а при постоянном объеме – только на изменение внутренней энергии. Поэтому
близки друг к другу по величине. Для разного рода практических расчетов их можно считать одинаковым. Сообщенное при постоянном давлении тепло идет на совершение работы и на изменение внутренней энергии, а при постоянном объеме – только на изменение внутренней энергии. Поэтому 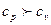 , а их отношение больше единицы и зависит от количества атомов, составляющих молекулу. Теплоемкости могут быть выражены через степени свободы молекул (число независимых переменных, полностью определяющих положение системы в пространстве):
, а их отношение больше единицы и зависит от количества атомов, составляющих молекулу. Теплоемкости могут быть выражены через степени свободы молекул (число независимых переменных, полностью определяющих положение системы в пространстве):
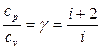 (3)
(3)
Отношение теплоемкостей газа при постоянном давлении и постоянном объеме 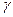 играет в термодинамике важную роль. В частности, оно входит в уравнение Пуассона, которое описывает адиабатный процесс.
играет в термодинамике важную роль. В частности, оно входит в уравнение Пуассона, которое описывает адиабатный процесс.
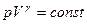 (4)
(4)
Процесс, при котором отсутствует теплообмен между системой и окружающей средой, называется адиабатным, т.е. 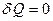 .
.
В случае адиабатного процесса из уравнения (1):
1) 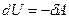 - работа внешних сил увеличивает внутреннюю энергию газа.
- работа внешних сил увеличивает внутреннюю энергию газа.
2) 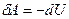 - газ совершает работу за счет убыли внутренней энергии системы
- газ совершает работу за счет убыли внутренней энергии системы
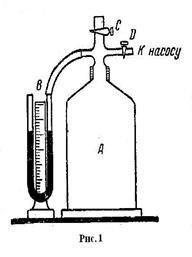
| Одним из простых методов определения пока-зателя адиабаты 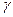 является метод Клемана-Дезорма. Экспериментальная установка сос-тоит из стеклянного баллона, соединенного с водяным манометром и насосом. Посредством крана баллон может быть соединен с атмосферой. Если в баллон накачать некоторое количество воздуха, то давление и температура в баллоне повысятся, но в результате теплообмена с внешней средой через некоторое время температура воздуха в баллоне сравнивается с температурой окружа- является метод Клемана-Дезорма. Экспериментальная установка сос-тоит из стеклянного баллона, соединенного с водяным манометром и насосом. Посредством крана баллон может быть соединен с атмосферой. Если в баллон накачать некоторое количество воздуха, то давление и температура в баллоне повысятся, но в результате теплообмена с внешней средой через некоторое время температура воздуха в баллоне сравнивается с температурой окружа-
|
ющей среды 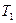 , а давление
, а давление 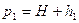 , где
, где 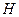 - атмосферное давление,
- атмосферное давление, 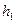 - избыточное давление, измеряемое разностью уровней жидкости в манометре. Таким образом, первое состояние газа определяется параметрами
- избыточное давление, измеряемое разностью уровней жидкости в манометре. Таким образом, первое состояние газа определяется параметрами 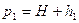 ,
, 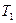 ,
, 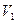 . Если открыть кран на короткое время, то воздух будет расширяться до объема
. Если открыть кран на короткое время, то воздух будет расширяться до объема 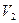 , давление упадет до атмосферного
, давление упадет до атмосферного 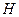 и температура понизится до
и температура понизится до 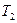 . Это будет второе состояние. Процесс перехода из состояния 1 в состояние 2 протекает очень быстро, поэтому его можно считать адиабатным. Согласно уравнению Пуассона
. Это будет второе состояние. Процесс перехода из состояния 1 в состояние 2 протекает очень быстро, поэтому его можно считать адиабатным. Согласно уравнению Пуассона 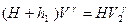 или
или 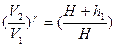 (5)
(5)
Через некоторое время газ нагреется вследствие теплообмена до температуры окружающей среды 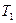 и давление возрастет до
и давление возрастет до 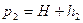 , где
, где 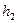 -новая разность уровней жидкости в манометре. Это новое третье состояние газахарактеризуется параметрами
-новая разность уровней жидкости в манометре. Это новое третье состояние газахарактеризуется параметрами 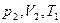 . Так как в первом и третьем состояниях температура одинакова, то параметры этих состояний можно связать уравнением Бойля-Мариотта:
. Так как в первом и третьем состояниях температура одинакова, то параметры этих состояний можно связать уравнением Бойля-Мариотта:
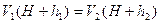 или
или 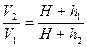 (6)
(6)
Подставляя отношение объемов из уравнения (6) в уравнение (5) получим 

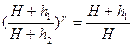
Прологарифмируем это выражение и найдем показатель адиабаты
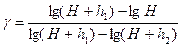
Так как значения давления мало отличаются друг от друга, в первом приближении разность логарифмов заменим разностью самих величин:
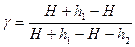 или
или 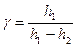 (7)
(7)
Дата добавления: 2015-01-26; просмотров: 727;
