Постулаты Бора
В 1913 г. Нильс Бор постулировал дискретность энергетических состояний атомов, откуда с необходимостью следует квантовый характер поглощения и излучения света.
Первый постулат Бора гласит: атом может находиться лишь в определенных дискретных энергетических состояниях, в которых он не излучает энергии, несмотря на ускоренные движения входящих в его состав заряжённых частиц. Такие состояния называются стационарными.
Согласно второму постулату атом излучает или поглощает энергию лишь при скачкообразном переходе из одного стационарного состояния в другое. При этом частота излученного или поглощенного кванта света пропорциональна разности энергии начального Е1и конечного Е2 состояний:
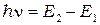 (1) Коэффициентом пропорциональности служит постоянная Планка h.
(1) Коэффициентом пропорциональности служит постоянная Планка h.
Постулаты Бора имеют чрезвычайно общий характер и применимы к любому атому или атомной системе. Их правильность многократно подтверждена экспериментально. Таким образом, теория Бора хорошо описывает физический механизм поглощения и излучения света.
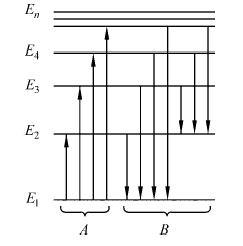
Рис. 1. Энергетические уровни атома и переходы между уровнями, сопровождаемые поглощением или излучением квантов света
Каждое стационарное состояние атома характеризуется определённой энергией Еn (n = 1,2,3,...∞). Поэтому принято говорить об энергетических уровнях данного атома и наглядно представлять их в виде схемы уровней энергии (рис.1).
На схеме по оси ординат откладываются дискретные значения энергии Еn стационарных состояний, а ось абсцисс не имеет никакой координаты. Горизонтальные прямые фиксированных значений Еn обозначают скачкообразные переходы электрона в атоме из одного стационарного состояния в другое. Стрелками вверх показано поглощение света. Стрелки вниз означают испускание кванта света с соответствующим уменьшением энергии атома. Частоты излучения и поглощения могут быть легко рассчитаны по формуле (1). Важно подчеркнуть, что спектральные переходы возможны строго между определенными уровнями энергии. Никаких промежуточных переходов в атоме быть не может. Следовательно, не может быть и квантов света с промежуточными значениями энергии, а значит и частоты  .
.
В современной квантовой механике строго доказано, что атомы каждого химического элемента имеют присущий только им набор возможных стационарных энергетических состояний. Переходы между этими состояниями и образуют спектр частот излучения (или поглощения), характерный только для данного элемента. Именно поэтому оказывается возможным отождествление химического элемента по его спектру испускания или поглощения, т.е. качественный спектральный анализ.
Число спектральных линий одинаковых атомов может быть очень велико. Например, спектр железа только в видимой и ультрафиолетовой областях содержит около 60 тысяч линий. У других многоэлектронных атомов число линий того же порядка. Следовательно, не исключено случайное совпадение некоторых частот в спектре различных атомов, что называется в спектроскопии “наложением” линий. Поэтому качественный спектральный анализ следует проводить по нескольким наиболее интенсивным линиям в исследуемом спектре. Совпадение измеренных длин волн этих линий с табличными данными надежно показывает присутствие элемента в источнике излучения.
Дата добавления: 2015-01-21; просмотров: 1894;
