Если система находится в состоянии термодинамического равновесия, то температура во всех ее частях одинакова.
нарушается, поскольку нулевой закон не выполняется. Но постепенно происходит изобарно-изохорное охлаждение
Третий закон термодинамики утверждает и доказывает, что
абсолютный ноль температуры недостижим любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение):
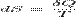 ,
,
третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики). В классической термодинамике энтропия может быть определена лишь с точностью до произвольной аддитивной постоянной S0, что не мешает термодинамическим исследованиям, так как реально измеряется разность энтропий (S0) в различных состояниях. Согласно третьему началу термодинамики, при  значение
значение  .
.
В 1911 году Макс Планк сформулировал третье начало термодинамики, как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю: 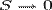 . Отсюда S0 = 0, что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность (W) состояния системы S = klnW. При абсолютном нуле температуры система находится в основном квантово-механическом состоянии. Если оно невырожденно, то W = 1 (состояние реализуется единственным микрораспределением) и энтропия S при
. Отсюда S0 = 0, что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность (W) состояния системы S = klnW. При абсолютном нуле температуры система находится в основном квантово-механическом состоянии. Если оно невырожденно, то W = 1 (состояние реализуется единственным микрораспределением) и энтропия S при  равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем могут стать существенными дискретность квантовых уровней макроскопической системы и влияние квантового вырождения.
равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем могут стать существенными дискретность квантовых уровней макроскопической системы и влияние квантового вырождения.
невозможны.
12.Растворы: понятие, классификация. краткая характеристика.
Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
Любой раствор состоит из растворителя и растворенного вещества.. Но не всегда обязательно вода является растворителем. Например, можно получить раствор воды в серной кислоте. Здесь растворителем будет кислота. Можно приготовить и растворы кислоты в воде. Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.Растворы не отстаиваются и сохранятся все время однородными. Если раствор профильтровать через самый плотный фильтр, то ни соль, ни сахар, ни марганцевокислый калий не удается отделить от воды. Следовательно, эти вещества в воде раздроблены до наиболее мелких частиц – молекул. Молекулы могут опять собраться в кристаллы только тогда, когда мы выпарим воду. Таким образом, растворы – это молекулярные смеси.
Существуют растворы не только жидкие, но и газовые и даже твердые. Например, воздух – раствор кислорода и еще нескольких газов в азоте. Сплавы металлов представляют собой твердые растворы металлов друг в друге. Газы, как мы уже знаем, способны растворяться в воде.
По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов).
Размеры частиц в истинных растворах - менее 10-9 м (порядка размеров молекул). По концентрации растворы делятся на: - Ненасыщенные;- Насыщенные;- Перенасыщенные.
Если молекулярные или ионные частицы, распределённые в жидком растворе присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, раствор называется насыщенным. (Например, если поместить 50 г NaCl в 100 г H2O, то при 20ºC растворится только 36 г соли). Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества.
Ненасыщенный раствор - раствор, содержащий меньше вещества, чем внасыщенном. Перенасыщенный раствор - раствор, содержащий больше вещества, чем в насыщенном.
Классификация растворов по содержанию растворенного вещества:
1. Разбавленный раствор - это раствор в котором содержание растворенного вещества больше чем 30%.
2. Концентрированный раствор - это раствор в котором содержание растворенного вещества менше чем 30%.
Дата добавления: 2015-03-20; просмотров: 1933;
