Род Staphylococcus. Некоторые виды основного сырья и вспомогательных материалов перед использованием подвергают предварительной тепловой обработке: бланшированию
Некоторые виды основного сырья и вспомогательных материалов перед использованием подвергают предварительной тепловой обработке: бланшированию, обжариванию, копчению, варке.
Бланширование– кратковременная варка сырья в воде, собственном соку или паровой среде до неполной готовности. Тепловая денатурация белков сопровождается уменьшением диаметра мышечных волокон, в результате чего выпрессовывается свободная влага, масса мяса после бланширования уменьшается на 40-45 %, а объем на 25-30 %, что позволяет максимально использовать полезную вместимость тары при фасовании содержимого и увеличить концентрацию пищевых веществ в продукте. Одновременно в процессе бланширования частично набухает и разваривается соединительная ткань, уменьшается ее прочность, возрастает проницаемость клеточных мембран, выделяются пузырьки воздуха, наличие которых в стерилизуемом продукте ускоряет окисление сырья, внутреннюю коррозию тары и приводит к повышению давления в банке при стерилизации. Бланширование вызывает инактивацию мышечных ферментов и гибель вегетативных форм микроорганизмов, находящихся в мясе, в результате чего повышается эффективность последующей стерилизации.
При бланшировании мяса в воде в значительной степени теряются растворимые пищевые вещества, минеральные соли и витамины, поэтому предпочтительнее проводить бланширование паром. Существует несколько способов бланширования сырья. Сырье бланшируют в машинах и аппаратах периодического и непрерывного действия.
К аппаратам периодического действия относится варочный опрокидывающийся котел. Аппаратом непрерывного действия является бланширователь ФБН.
Бланширование проводят в котлах различной конструкции с загрузкой и выгрузкой вручную и специальными устройствами с опрокидывающимся и неопрокидывающимся резервуаром.
Котел Г2-ФВА (рис. 1, а) с опрокидывающимся резервуаром и рубашкой опирается через цапфы, лежащие в подшипниках, на стойки. К цапфам подсоединены трубы для подвода пара в рубашку и отвода конденсата, поступающего по трубе. На цапфу надето червячное колесо, вращением которого при помощи маховика и червяка поворачивают резервуар.
Котел типа «Вулкан» (рис. 1, б) имеет резервуар с коническим днищем и рубашку. Сверху он закрыт крышкой, уравновешенной противовесом. Рубашка опирается на стойки. Пар в рубашку поступает через вентиль, а содержимое котла сливается через кран; вода поступает в резервуар через трубу 9, конденсат отводится через конденсатную трубу . Для снижения давления в котле служит патрубок, отводящий пар. Рубашка котла имеет клапаны для продувки и предохранительный, а резервуар — предохранительный клапан, исключающий образование внутри вакуума.
Котел К7-ФВЗ-Е предназначен для варки и бланшировки субпродуктов и варки окороков в двух корзинах из нержавеющей стали. Он представляет собой бескаркасную прямоугольную металлоконструкцию (резервуар), под которой расположен слой теплоизоляции толщиной 50 мм. Днище и крышка двухстворчатой конструкции изоляции не имеют. Посередине котла на вертикальных внутренних стенках закреплена перегородка, разделяющая его на две части и служащая направляющей для корзин. Крышка открывается и закрывается с помощью рычажно-винтовой системы, смонтированной с правой стороны
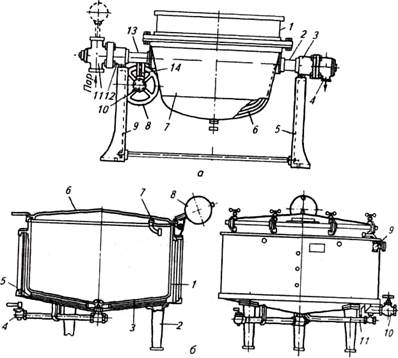
Рис. 1, а – котел Г2-ФВА; б – котел типа «Вулкан»
Обжаривание – это тепловая обработка продуктов в присутствии достаточно большого количества жира. Жир, являясь жидкой теплопередающей средой, позволяет равномерно нагревать всю поверхность мяса на определенную глубину, но защищает его от сильного перегрева. Кроме того, жир при обжаривании пропитывает продукт, увеличивая его пищевую ценность.
В процессе обжаривания поверхностный слой мяса обезвоживается и уплотняется. Последующий термический распад составных частей мяса на поверхности приводит к образованию летучих веществ, участвующих в формировании специфического аромата и вкуса. При обжаривании происходит частичный гидролиз жира до глицерина и свободных жирных кислот, а также гидротермическое расщепление 10-20 % коллагена соединительной ткани.
Степень образования ароматических веществ и их вид зависят от температуры обжаривания: при 105-130 °С отмечается начальный этап образования летучих веществ, при 150-160 °С процесс интенсифицируется, при 180 °С возможно появление веществ с неприятным вкусом и запахом.
При обжаривании следует учитывать не только температуру и продолжительность процесса, но и размеры обрабатываемых кусков сырья.
Род Staphylococcus.
В состав рода входит более 20 видов, из которых наибольшее значение имеют S.aureus (золотистый стафилококк), S.epidermidis, S.saprophyticus.
Культуральные свойства. Факультативные анаэробы, хемоорганотрофы. Хорошо растут на простых питательных средах, в том числе на средах с 5- 10% NaCl. Температурный оптимум от +35 до +37о С, рН 6-8 (лучше слабощелочная реакция среды). На плотных средах образуют непрозрачные круглые (2-4 мм в диаметре) ровные колонии, окрашенные в цвет липохромного пигмента (кремовый, желтый, оранжевый). Кроме S- форм колоний могут образовывать R- формы. На жидких средах дают равномерное помутнение, затем выпадает рыхлый осадок.
Среди патогенных видов коагулаза - положителен лишь S.aureus, остальные - отрицательны.
Антигенная структура очень сложная (более 50 типов антигенов). По специфичности антигены подразделяют на родовые (общие для стафилококков), перекрестнореагирующие (с изоантигенами эритроцитов, кожи и почки человека), видо- и типоспецифические.
Видоспецифическими антигенами являются тейхоевые кислоты, белок А золотистого стафилококка. Антигенными свойствами обладают токсины.
Факторы патогенности. К ним относят микрокапсулу, компоненты клеточной стенки (тейхоевые кислоты, белок А), ферменты и токсины.
1. Факторами адгезии являются высокие гидрофобные свойства поверхностных структур.
2. Компоненты клеточной стенки стимулируют развитие воспалительных реакций, основное значение в них имеют нейтрофилы.
3. Разнообразные ферменты стафилококков играют роль факторов агрессии и защиты. Главным фактором является плазмокоагулаза, свертывающая сыворотку (плазму) крови и образующая тромбиноподобное вещество, обвалакивающее стафилококки и препятствующее действию защитных реакций организма. Кроме нее - фибролизин, ДНК- аза, лецитиназа, фосфатаза.
4. Стафилококки синтезируют обширный комплекс экзотоксинов.
Мембраноповреждающие токсины могут повреждать эритроциты (гемолизины), лейкоциты, макрофаги, тромбоциты и др. Выделяют несколько типов, отличающихся по антигенной структуре, спектру лизируемых клеток, скорости действия.
Эксфолиативные токсины оказывают дерматонекротическое действие (пузырчатка новорожденных).
Экзотоксин, вызывающий синдром токсического шока. Высокосорбционные тампоны вызывали тяжелый эндотоксический шок у женщин.
Энтеротоксины, с которыми связаны пищевые интоксикации. Энтеротоксины - термостабильные белки со свойствами суперантигенов. Они вызывают избыточный синтез интерлейкина 2, который и обусловливает интоксикацию. Интоксикации чаще связаны с употреблением инфицированных стафилококками молочных продуктов.
5. Ряд экзотоксинов и других структур стафилококков обладают аллергизирующим действием, обусловливая эффект развития ГЗТ. Наличие перекрестно - реагирующих антигенов способствует развитию аутоиммунных процессов.
6. Факторы, угнетающие фагоцитоз - капсула, белок А, тейхоевые кислоты, пептидогликан, токсины.
Генетика. Для стафилококков характерна высокая изменчивость, связанная с мутациями и рекомбинациями. У них могут быть различные плазмиды. Особенно распространены штаммы с плазмидами устойчивости к различным антибиотикам (прежде всего - к пенициллинам). Выделяют фаготипы и проводят фаготипирование стафилококков. Для типирования используют наборы умеренных фагов.
Особые свойства возбудителя.
1. Способность поражать практически любую ткань и орган.
2. Очень высокая устойчивость среди неспорообразующих бактерий к факторам внешней среды.
3. Постоянное пребывание на кожных покровах и сообщающихся с внешней средой слизистых оболочках.
4. Суперантигенные свойства.
5. Высокая изменчивость и антибиотикорезистентность, что имеет важное значение для эпидемического процесса.
Эпидемиологические особенности. Стафилококковые инфекции могут носить характер эндогенной инфекции (повреждение органов и тканей с проникновением возбудителя) или экзогенный характер, обусловленный различными путями заражения - алиментарным (при стафилококковых отравлениях), контактно - бытовым, воздушно - капельным и воздушно - пылевым.
Существенное значение имеет носительство патогенных стафилококков, чаще всего - на слизистой носа и зева, на втором месте - кожа. В условиях медицинских учреждений (родильные дома, хирургические стационары) и в закрытых коллективах особую опасность представляют резидентные (постоянные) носители, у которых наблюдается колонизация слизистых носа и зева и длительная персистенция стафилококков. Длительное носительство в определенной мере связано с дефицитом местного секреторного иммунитета (секреторного IgA в первую очередь) и хроническими очагами воспаления в организме.
Особенности клиники и патогенеза. Только инфекции, вызываемые золотистым стафилококком, включают более 100 нозологических форм. Стафилококковые инфекции можно разделить на локальные и системные (генерализованные). Среди первых - фурункулы, панариции, мастит, гнойные осложнения раневых поверхностей. Среди вторых - сепсис (септицемия - “гнилокровие” с размножением возбудителя в крови, септикопиемия - сепсис с гнойными очагами - метастазами), стафилококковые пневмонии, осложнения после родов и операций, приводящих к синдрому токсического шока, остеомиелиты и др.
Постинфекционный иммунитет при стафилококковых инфекциях можно разделить на клеточный и гуморальный, антибактериальный и антитоксический. В связи с очень разнообразной и изменчивой антигенной структурой перекрестного иммунитета у стафилококков нет. В защите важную роль имеют антитоксины, антибактериальные антитела, антитела против ферментов патогенности, Т- лимфоциты, фагоциты (тканевые макрофаги при локализованных формах).
Способность белка А взаимодействовать с любыми (не только специфическими к стафилококку) иммуноглобулинами затрудняет серологическую диагностику стафилококковых инфекций, особенно сепсиса. За счет этого механизма (наличия белка А в крови) у этих больных могут быть выявлены ложноположительные серологические тесты на другие инфекции.
Способность стафилококков за счет белка А нагружаться иммуноглобулинами (в т.ч. специфическими антителами к различным возбудителям) используется в реакции коагглютинации. Насаженные на стафилококки (стафилококковый реагент из инактивированных микробных клеток) специфические антитела за счет свободных активных центров при взаимодействии с соответствующим антигеном (суспензией культуры микроорганизма) дают быструю реакцию агглютинации (коагглютинации - поскольку антитела агглютинируют культуру не самостоятельно, а в комплексе со стафилококками, что и обеспечивает быстрое осаждение тяжелых - нагруженных стафилококками комплексов совместно со специфическим искомым агентом).
Белок А широко используют также в ИФА для выявления специфических IgG- антител (конъюгаты “белок А - пероксидаза”), стафилококковый реагент - для дифференциации титров IgG- и IgM- антител в серологических реакциях по снижению титров IgG- антител после обработки проб сыворотки крови стафилококковым реагентом.
Профилактика и лечение - это наиболее сложные вопросы стафилококковых инфекций. Для проведения адекватной антимикробной терапии необходимо определение чувствительности культур к антибиотикам ( прежде всего - к бета- лактамовым), в тяжелых и затяжных случаях применяют донорский антистафилококковый иммуноглобулин. Определенный эффект может оказать фаготерапия. Для создания иммунитета применяют стафилококковый анатоксин, создающий антитоксический иммунитет. Современные вакцины недостаточно эффективны, поскольку иммунитет при стафилококковых инфекциях типоспецифический (к определенному сероварианту).
Лекция №2. Стрептококки. Гонококки, менингококки.
Стрептококки.
В семейство Streptococcaceae входит семь родов, из которых для человека наибольшее значение имеют стрептококки (род Streptococcus) и энтерококки (род Enterococcus). Наиболее значимые виды - S.pyogenes (стрептококки группы А), S.agalactiae (стрептококки группы В), S.pneumoniae (пневмококк), S.viridans (зеленящие стрептококки, биогруппа mutans), Enterococcus faecalis.
Факультативные (большинство) или строгие анаэробы.
. Способны образовывать L- формы.
Бета - гемолитические стрептококки при росте на кровяном агаре образуют вокруг колонии четкую зону гемолиза, альфа - гемолитические - частичный гемолиз и позеленение среды (превращение окси- в метгемоглобин), гамма- гемолитические - на кровяном агаре гемолиза незаметно. Альфа - гемолитические стрептококки за зеленый цвет среды называют S.viridans (зеленящими).
Наибольшее значение имеют стрептококки серогрупп А,В и D.
У стрептококков серогруппы А имеются типоспецифические антигены - белки М, Т и R. По М- антигену гемолитические стрептококки серогруппы А подразделены на серовары (около 100).
Стрептококки имеют перекрестно - реагирующие антигены с антигенами клеток базального слоя эпителия кожи, эпителиальных клеток корковой и медуллярной зон тимуса. В клеточной стенке стрептококков обнаружен также антиген (рецептор II), способный взаимодействовать с Fс- фрагментом IgG.
Факторы патогенности стрептококков.
1. Белок М- главный фактор. Определяет адгезивные свойства, угнетает фагоцитоз, определяет типоспецифичность, обладает свойствами суперантигена. Антитела к М- белку обладают протективными свойствами.
2. Капсула - маскирует стрептококки за счет гиалуроновой кислоты, аналогичной гиалуроновой кислоте в тканях хозяина.
3. С5а - пептидаза - расщепляет С5а - компонент комплемента, чем снижает хемоатрактивную активность фагоцитов.
4. Стрептококки вызывают выраженную воспалительную реакцию, в значительной степени обусловленную секрецией более 20 растворимых факторов - ферментов (стрептолизины S и О, гиалуронидаза, ДНК- азы, стрептокиназа, протеазы) и эритрогенных токсинов.
Эритрогенин - скарлатинозный токсин, обусловливающий за счет иммунных механизмов образование ярко красной скарлатинозной сыпи. Выделяют три серологических типа этого токсина (А,В и С). Токсин обладает пирогенным, аллергенным, иммуносупрессивным и митогенным действием.
Генетика. Мутации и рекомбинации менее выражены, чем у стафилококков. Способны синтезировать бактериоцины. Фаги для дифференциации не применяют.
Эпидемиологические особенности. Основными источниками являются больные острыми стрептококковыми инфекциями (ангина, пневмония, скарлатина), а также реконвалесценты. Механизм заражения - воздушно - капельный, реже - контактный, очень редко - алиментарный.
Клинико - патогенетические особенности. Стрептококки - обитатели слизистых верхних дыхательных путей, пищеварительного и моче - полового трактов, вызывают различные заболевания эндо- и экзогенного характера. Выделяют локальные (тонзиллит, кариес, ангины, отиты и др.) и генерализованные инфекции (ревматизм, рожистое воспаление, скарлатина, сепсис, пневмония, стрептодермии и др.). Развитие тех или иных форм зависит от ряда условий, в т.ч. от входных ворот, различных факторов патогенности, состояния иммунной системы (особую роль играют антитоксины и типоспецифические М- антитела).
Особое положение в роде Streptococcus занимает вид S.pneumoniae (пневмококк) - этиологический агент крупозной пневмонии, острых и хронических воспалительных заболеваний легких. От остальных стрептококков отличается морфологией (чаще диплококки в форме пламени свечи, плоскими концами друг к другу, обладают выраженной капсулой), антигенной специфичностью (имеют 83 серовара по капсульному полисахаридному антигену), высокой чувствительностью к желчи и оптохину, вызывают альфа - гемолиз. Главный фактор патогенности - полисахаридная капсула.
Скарлатину вызывают различные серотипы бета - гемолитических стрептококков, обладающих М- антигеном и продуцирующих эритрогенин (токсигенные стрептококки серогруппы А). При отсутствии антитоксического иммунитета возникает скарлатина, при наличии - ангина.
Грамотрицательные аэробные и факультативно - анаэробные кокки.
Наибольшее значение имеет род Neisseria, из видов - N.gonorrhoeae - гонококк и N.meningitidis - менингококк, остальные виды нейссерий - комменсалы.
Морфология. Нейссерии - диплококки, напоминающие кофейные зерна или бобы, прилегающие друг к другу уплощенными сторонами. Для них характерно наличие капсулы, а также пилей и ворсинок, облегчающих адгезию патогенных нейссерий к эпителию.
N.gonorrheae (гонококк).
Гонококк - возбудитель гонореи - венерического заболевания с воспалительными проявлениями в моче- половых путях. Субстрат для колонизации - эпителий уретры, прямой кишки, конъюнктивы глаза, глотки, шейки матки, маточных труб и яичника.
Антигенная структура очень изменчива - характерны фазовые вариации (исчезновение антигенных детерминант) и антигенные вариации (изменение антигенных детерминант). Основную антигенную нагрузку несут детерминанты пилей и поверхностных белков. С высокой антигенной изменчивостью связано отсутствие иммунной защиты против повторного заражения. Наибольшее антигенное родство - с менингококками.
Факторы патогенности. Основными факторами являются пили, с помощью которых гонококки осуществляют адгезию и колонизацию эпителиальных клеток слизистой оболочки моче- половых путей, и липополисахарид (эндотоксин, освобождающийся при разрушении гонококков). Гонококки синтезируют IgAI- протеазу, расщепляющую IgA.
Генетика. Характерна генетическая изменчивость, даже на протяжении жизни одной микробной популяции. Передача информации осуществляется преимущественно конъюгацией. Выявлены F- и R- плазмиды, в т.ч. плазмиды, несущие ген бета - лактамазы.
N.meningitidis (менингококки).
Менингококк - возбудитель менингококковой инфекции - строгого антропоноза с воздушно - капельной передачей возбудителя. Основной источник - носители. Природный резервуар - носоглотка человека. Морфологические, культуральные и биохимические свойства аналогичны гонококку. Отличия - ферментируют не только глюкозу, но и мальтозу, продуцируют гемолизин. Обладают капсулой, имеющей большие размеры и другое строение, чем у гонококка.
Антигенный состав. Имеют четыре основные антигенные системы.
1. Капсульные группоспецифические полисахаридные антигены. Штаммы серогруппы А наиболее часто вызывают эпидемические вспышки.
2. Белковые антигены наружной мембраны. По этим антигенам менингококки серогрупп В и С подразделены на классы и серотипы.
3. Родо- и видоспецифические антигены.
4. Липополисахаридные антигены (8 типов). Имеют высокую токсичность, вызывают пирогенное действие.
Факторы патогенности. Факторы адгезии и колонизация - пили и белки наружной мембраны. Факторы инвазивности - гиалуронидаза и другие продуцируемые ферменты (нейраминидаза, протеазы, фибринолизин). Большое значение имеют капсульные полисахаридные антигены, защищающие микроорганизмы от фагоцитоза.
Иммунитет стойкий, антимикробный.
Лекция №3. Клостридии.
Общая характеристика патогенных анаэробных бактерий.
Облигатные анаэробы - микроорганизмы, живущие только в условиях крайне низкого содержания кислорода - в почве, иле водоемов, кишечниках позвоночных и человека. У теплокровных анаэробы составляют основную массу нормальной кишечной микрофлоры и определяют ряд важнейших функций организма.
Разнородную группу анаэробных грамположительных бактерий дифференцируют прежде всего по способности к спорообразованию и морфологическим особенностям. В патологии человека наибольшее значение имеют анаэробные спорообразующие бактерии рода Clostridium. Среди неспорообразующих грамположительных анаэробов медицинское значение имеют семейство лактобацилл (Lactobacillaceae) и род бифидобактерий (Bifidibacterium), в патологии - неспорообразующие грамотрицательные анаэробы родов Bacteroides (бактероиды) и Fusobacterium (фузобактерии).
Род Clostridium.
Это подвижные крупные палочки (большинство видов), образуют овальные или круглые эндоспоры, придающие клостридиям (греч. kloster - веретено) ветеренообразную форму. Спора в диаметре больше диаметра (поперечника) вегетативной клетки. Грамположительны, хемоорганотрофы. Строгие анаэробы.
По экологическим и патогенным свойствам можно выделить три группы клостридий: - сапрофиты, вызывающие бродильные (сахаролитические) процессы;
- сапрофиты, вызывающие процессы гниения (протеолиза);
- патогенные виды - по биохимическим свойствам могут вызывать процессы гниения и брожения. Патогенные виды клостридий условно разделить на три группы - возбудителей травматических (раневых) клостридиозов - газовой гангрены, столбняка, возбудителей энтеральных клостридиозов (токсикоинфекций) - ботулизма, псевдомембранозного колита и виды, вызывающие патологические процессы только в ассоциациях между собой или с другими микроорганизмами.
Современная систематика выделяет пять групп клостридий по расположению спор, способности гидролизовать желатин и наличию особых условий для роста. Все патогенные для человека виды ферментируют желатин, отличаясь расположением спор - терминальное (в виде тенисных ракеток) у четвертой группы (C.tetani - возбудитель столбняка), субтерминальное (веретено) у второй группы (остальные возбудители: C.botulinum- возбудитель ботулизма, C.perfringens и другие возбудители газовой гангрены, C.difficile - возбудитель псевдомембранозного колита).
Микробиология газовой гангрены.
Газовая гангрена - анаэробная поликлостридиальная (т.е. вызываемая различными видами клостридий) раневая (травматическая) инфекция. Основное значение имеет C.perfringens, реже - C.novyi, а также другие виды клостридий в стойких ассоциациях между собой, аэробными гноеродными кокками и гнилостными анаэробными бактериями.
C.perfringens - нормальный обитатель кишечников человека и животных, в почву попадает с испражнениями. Является возбудителем раневой инфекции - вызывает заболевание при попадании возбудителя в анаэробных условиях в раны. Обладает высокой инвазивностью и токсигенностью. Инвазивность связана с выработкой гиалуронидазы и других ферментов, оказывающих разрушающее действие на мышечную и соединительную ткани. Главный фактор патогенности - экзотоксин, оказывающий гемо-, некро-, нейро-, лейкотоксическое и летальное воздействие. В соответствии с антигенной специфичностью экзотоксинов выделяют серотипы возбудителя. Наряду с газовой гангреной C.perfringens вызывает пищевые токсикоинфекции (в их основе - действие энтеротоксинов и некротоксинов).
Особенности патогенеза. В отличии от гнойных заболеваний, вызываемых аэробами, при анаэробной инфекции преобладает не воспаление, а некроз, отек, газообразование в тканях, отравление токсинами и продуктами распада тканей. Клостридии - некропаразиты, активно создающие анаэробные условия и вызывающие некроз тканей, т.е. условия для своего размножения. Некроз мышечной и соединительной тканей - следствие некротоксического действия токсинов и ферментов, газообразование в тканях - результат ферментативной активности клостридий. Общее действие токсинов (общая интоксикация) проявляется преимущественно в нейротоксическом воздействии.
Иммунитет - преимущественно антитоксический.
Профилактика и лечение. В основе предупреждения газовой гангрены - своевременная и правильная хирургическая обработка ран. При тяжелых ранениях вводят антитоксические сыворотки против основных видов клостридий по 10 тысяч МЕ, в лечебных целях - по 50 тысяч МЕ.
Clostridium difficile.
Это представитель нормальной микрофлоры кишечника, редко вызывает газовую гангрену, является возбудителем псевдомембранозного энтероколита - результата нерациональной антибиотикотерапии и развития дисбактериоза, обусловленного доминированием этого возбудителя. При применении антибиотиков (особенно клиндомицина, ампициллина и цефалоспоринов) и цитостатиков возникает глубокий дисбаланс микрофлоры кишечника и колонизация его C.difficile. Токсический компонент патогенности этого вида клостридий состоит из энтеротоксина и цитотоксина. Возбудитель проявляет высокую резистентность к антибиотикам широкого спектра, что способствует массированной колонизации кишечника и секреции большого количества токсинов, вызывающих изменения кишечной стенки. Псевдомембранозный колит - госпитальная инфекция, доминирующая среди кишечных поражений, однако бактериологически трудно выявляемая (сложности выделения и изучения анаэробов).
Микробиология столбняка.
Столбняк - острая раневая инфекция, характеризующаяся поражением нейротоксином двигательных клеток спинного и головного мозга, которое проявляется в виде судорог поперечно - полосатой мускулатуры. Болеют люди и сельскохозяйственные животные. Почва, особенно загрязненная испражнениями человека и животных, является постоянным источником заражения столбняком.
Возбудитель - C.tetani - крупная спорообразующая грамположительная палочка. Споры располагаются терминально (вид барабанной палочки), подвижна за счет жгутиков - перитрихов. Обязательный анаэроб. Споры обладают очень высокой устойчивостью.
Антигенные свойства. Возбудитель имеет О- и Н- антигены.
Факторы патогенности. Главный фактор - сильнейший экзотоксин. Выделяют две его основные фракции - тетаноспазмин (нейротоксин) и тетанолизин (гемолизин). Нейротоксин в центральную нервную систему проникает в области мионевральных синапсов, передается от нейрона к нейрону в области синапсов, накапливается в двигательных зонах спинного и головного могза, блокирует синаптическую передачу. Смерть наступает от паралича дыхательного центра, асфиксии (поражение мышц гортани, диафрагмы, межреберных мышц) или паралича сердца.
Лечение и экстренная профилактика. Используют донорский противостолбнячный иммуноглобулин (антитоксин), антитоксическую сыворотку (350МЕ/кг), антибиотики (пенициллины, цефалоспорины). Для создания вакцинального иммунитета используют столбнячный анатоксин, чаще в составе АКДС вакцины (анатоксины столбняка, дифтерии и убитые коклюшные палочки).
Микробиология ботулизма.
Ботулизм - тяжелая пищевая токсикоинфекция, связанная с употреблением продуктов, зараженных C.botulinum, и характеризующаяся специфическим поражением центральной нервной системы. Свое название получила от лат. botulus - колбаса.
Свойства возбудителя. Крупные полиморфные грамположительные палочки, подвижные, имеют перитрихиальные жгутики. Споры овальные, располагаются субтерминально (тенисная ракетка). Образуют восемь типов токсинов, отличающихся по антигенной специфичности, и соответственно выделяют 8 типов возбудителя. Среди важнейших характеристик - наличие или отсутствие протеолитических свойств (гидролиз казеина, продукция сероводорода).
Токсин оказывает нейротоксическое действие. Токсин попадает в организм с пищей, хотя вероятно может накапливаться при размножении возбудителя в тканях организма. Токсин термолабильный, хотя для полной инактивации необходимо кипячение до 20 мин. Токсин быстро всасывается в желудочно - кишечном тракте, проникает в кровь, избирательно действует на ядра продолговатого мозга и ганглиозные клетки спинного мозга. Развиваются нервно - паралитические явления - нарушения глотания, афония, дисфагия, офтальмо - плегический синдром (косоглазие, двоение в глазах, опущение век), параличи и парезы глоточных и гортанных мышц, остановка дыхания и сердечной деятельности.
Лабораторная диагностика. Принципы - общие для клостридий. Выделяют и идентифицируют возбудитель, однако наибольшее практическое значение имеет обнаружение ботулотоксина и определение его серотипа.
Для выделения возбудителя пробы сеют на плотные среды и накопительную среду Китта - Тароцци (часть материала предварительно прогревают при +85о С).
Лечение и профилактика. В основе - раннее применение антитоксических сывороток (поливалентных или при установлении типа - гомологичных). В основе профилактики - санитарно - гигиенический режим при обработке пищевых продуктов. Особенно опасны грибные консервы домашнего приготовления и другие продукты, хранящиеся в анаэробных условиях.
Лекция №4. Коринебактерии. Бордетеллы.
Род Corynebacterium.
Возбудитель дифтерии - Corynebacterium diphtheriae и большая группа близких по морфологическим и биохимическим свойствам микроорганизмов рода коринебактерий называют коринеформными бактериями или дифтероидами.Они представлены грамположительными неподвижными палочками, чаще с утолщениями на концах, напоминающими булаву (coryne - булава). Дифтероиды широко распространены в почве, воздухе, пищевых продуктах (молоке). Среди них можно выделить три экологические группы:
- патогены человека и животных;
- патогены растений;
- непатогенные коринебактерии.
Многие виды дифтероидов являются нормальными обитателями кожи, слизистых зева, носоглотки, глаз, дыхательных путей, уретры и половых органов.
Дифтерия.
Дифтерия - острое инфекционное заболевание преимущественно детского возраста, которое характеризуется интоксикацией организма дифтерийным токсином и характерным фибринозным (дифтеритическим) воспалением в месте локализации возбудителя (phther - пленка).
У этого возбудителя выделяют биотипы - gravis, mitis, intermedius, отличающиеся по морфологии, антигенным и биохимическим свойствам, тяжести заболеваний у человека. Тип gravis чаще вызывает вспышки и более тяжелое течение, для него характерны крупные с неровными краями и радиальной исчерченностью колонии в виде маргаритки (R- формы). Тип mitis вызывает преимущественно легкие спорадические заболевания, образует на плотных средах мелкие гладкие колонии с ровными краями (S- формы). Тип intermedius занимает промежуточное положение, образует на плотных средах переходные по характеристикам RS- формы, однако еще более мелкие. На жидких средах вызывают помутнение сред, образуют крошковидный осадок.
Биохимические свойства. Коринебактерии дифтерии ферментируют глюкозу, мальтозу. Отсутствие активности в отношении сахарозы и мочевины - важный дифференциальный признак среди дифтероидов. Обладают цистеназной активностью (расщепляют цистеин) - проба Пизу.
Антигенная структура. Выделяют О- и К- антигены. Полисахаридные компоненты О- антигенов клеточной стенки обладают межродовыми свойствами, обусловливая неспецифические перекрестные реакции с микобактериями, актиномицетами (нокардиями).
Поверхностные К- антигены - капсульные белки, обладают видовой специфичностью и иммуногенностью. Выделяют 11 серотипов. Серотипы 1-5 и 7 относятся к биовару gravis. Серотипирование культур проводят в РА с диагностическими сыворотками к соответствующим сероварам и полигрупповой агглютинирующей сывороткой.
В серологической диагностике у людей чаще применяют РПГА, более чувствительную, чем РА. В настоящее время применяют также ИФА. Многие штаммы коринебактерий дифтерии (особенно нетоксигенные) обладают спонтанной агглютинабельностью и полиагглютинабельностью.
Факторы патогенности. Токсигенные штаммы возбудителя дифтерии продуцируют сильный экзотоксин (термолабильный высокотоксичный иммуногенный белок). Нетоксигенные штаммы не вызывают заболевания.
Токсин вызывает необратимое блокирование удлинения полипептидной цепи, т.е. любого белкового синтеза. Поражаются в основном определенные системы: симпатико - адреналовая, сердце и кровеносные сосуды, периферические нервы. Отмечаются структурные и функциональные нарушения миокарда, демиелинизация нервных волокон, приводящая к параличам и парезам.
Способность к токсинообразованию проявляют лишь лизогенные штаммы, инфицированные бактериофагом (бета - фагом), несущим ген tox, который кодирует структуру токсина (т.е. несущие гены умеренного профага в своей хромосоме). Фаготипирование применяют для дифференциации штаммов коринебактерий дифтерии.
Эпидемиология. Резервуар - человек (больной, реконвалесцент, бактерионоситель). Основной путь передачи - воздушно - капельный, сезонность - осенне - зимняя. Возбудитель хорошо сохраняется при низких температурах, высушенном состоянии (слюна, слизь, пыль).
Клинико - патогенетические особенности. Возбудитель в месте внедрения вызывает фибринозное воспаление с образованием плотно спаянной с тканями фибринозной пленки. Существенное значение в вызываемой патологии имеет действие экзотоксина (описано в разделе “факторы патогенности” ). По локализации выделяют дифтерию ротоглотки (наиболее часто), дыхательных путей, носа и редкой локализации (глаза, наружные половые органы, кожа, раневая поверхность). Дифтерия зева может быть причиной крупа и асфиксии.
Лечение. Используют антитоксическую противодифтерийную сыворотку, антибиотики и сульфаниламидные препараты.
Постинфекционный иммунитет - стойкий, преимущественно антитоксический. Для количественного определения уровня антитоксического иммунитета ранее применялась проба Шика (внутрикожное введение токсина), сейчас - РПГА с эритроцитарным диагностикумом, получаемым сенсибилизацией эритроцитов дифтерийным анатоксином.
Профилактика. В основе - массовая иммунизация населения. Используют различные препараты, содержащие дифтерийный анатоксин - АКДС, АДС, АДС- М, АД и АД- М.
Род Bordetella.
Бордетеллы - мелкие коккобациллы, имеют форму овоидной палочки, грамотрицательны, неустойчивы во внешней среде. Основное значение имеют три вида.
1. B.pertussis - возбудитель коклюша - острого инфекционного заболевания, сопровождающегося воспалением гортани, трахеи и бронхов и приступообразным кашлем.
2. B.parapertussis - возбудитель паракоклюша.
3. B.bronchiseptica - возбудитель коклюшеподобного заболевания собак, кошек и кроликов, может вызывать у людей респираторные заболевания по типу ОРВИ (относительно редко).
Культуральные особенности. Бордетеллы требовательны к средам, особенно возбудитель коклюша. Для первичной изоляции этих гемофильных микроорганизмов используют картофельно - глицериновый агар с добавлением крови (среду Борде - Жангу) или казеиново - угольный агар (КУА). На кровяных средах возбудитель коклюша вызывает образование мелких колоний металлического оттенка с потемнением сред, на КУА - буровато - коричневое окрашивание колоний. Основные формы колоний - гладкие (S) - так называемая Iфаза (вирулентные культуры) через промежуточные формы переходят в шероховатые (R) - фаза IV, что сопровождается изменением культуральных, биохимических и антигенных свойств, потерей вирулентности.
Антигенный состав. Имеются общие (родовые) и специфические (видовые) антигены. Видоспецифическими являются соматические О- антигены (агглютиногены), выявляемые в РА.
Факторы патогенности. Главный фактор - термолабильный экзотоксин белковой природы, обладающий тропизмом к нервной и сосудистой системе. Имеется термостабильный эндотоксин, обладающий токсическими и сенсибилизирующими свойствами. Трахеальный цитотоксин вызывает повреждение мерцательного эпителия. Бактерии продуцируют гиалуронидазу, лецитиназу, плазмокоагулазу.
Эпидемиология. Источник инфекции при коклюше и паракоклюше - больные типичными и стертыми формами инфекции. Механизм заражения - воздушно - капельный. Возбудитель, попавший на слизистую оболочку дыхательных путей, размножается, выделяет экзо- и эндотоксины, некротизирует слизистую, раздражают кашлевые рецепторы и кашлевой центр продолговатого мозга, вызывает спазматические приступы кашля.
Лечение. В основе лечения - антибактериальная терапия антибиотиками (гентамицин, ампициллин и др.).
Иммунитет и иммунопрофилактика. Постинфекционный иммунитет стойкий, видоспецифический, обусловлен гуморальными и клеточными факторами.
Для вакцинации используют убитые бордетеллы I фазы. В вакцине АКДС имеется коклюшный компонент (20 млрд микробных тел/ мл).
Лекция №5. Микобактерии.
Род Mycobacterium.
. Для них характерно высокое содержание липидов и восков в клеточных стенках, что обеспечивает устойчивость к спиртам, кислотам, щелочам, дезинфицирующим средствам, высушиванию и действию солнечных лучей, плохую окрашиваемость красителями, высокую гидрофобность, патогенность.
Наряду с кислотоустойчивостью, важной характеристикой микобактерий является медленный рост на питательных средах, особенно микобактерий туберкулеза. Еще одна особенность микобактерий - образование пигментов, часть видов образует пигмент в темноте.
Среди патогенных микобактерий наибольшее значение имеют основной возбудитель туберкулеза человека - M.tuberculosis (палочка Коха), M.bovis - возбудитель туберкулеза крупного рогатого скота и M.leprae - возбудитель проказы (лепры). Заболевания у людей могут вызывать также M.avium - возбудитель туберкулеза птиц и около 20 других потенциально патогенных видов, способных вызывать у человека атипичные формы поражений (микобактериозы).
Mycobacterium tuberculosis (палочка Коха).
Культуральные свойства. Растут в аэробных и факультативно - анаэробных условиях. Растут очень медленно - в течении нескольких недель. Микобактерии нуждаются в белке и глицерине, факторах роста. Наиболее часто используют плотные яичные среды Левенштайна - Йенсена, Финна II, синтетические и полусинтетические жидкие среды.
На плотных средах рост отмечается на 15-40 сутки в виде сухого морщинистого налета кремового цвета (R- формы), колонии по виду напоминают цветную капусту. На жидких средах отмечается рост в виде поверхностной пленки.
Палочка Коха устойчива во внешней среде, в высохших биосубстратах сохраняется до нескольких недель.
Факторы патогенности. Патогенные свойства туберкулезной палочки и биологические реакции, которыми отвечает макроорганизм на внедрение возбудителя, связано с особенностями его химического состава, высоким содержанием липидов и их составом (наличие жирных кислот - фтиоидной, миколовой, туберкулостеариновой и др., фосфатидов и других фракций).
Главный фактор - токсичный гликолипид - “корд - фактор”, легко выявляемый при культивировании на жидких средах. Он обеспечивает сближенное расположение микобактерий в виде кос, жгута, корда. Корд - фактор оказывает токсическое действие на ткани, а также блокирует окислительное фосфорилирование в митохондриях макрофагов (защищает от фагоцитоза). С химическим составом микобактерий связаны еще две их важнейшие характеристики:
- незавершенный фагоцитоз этого внутриклеточного паразита (механизмы - блокада фагосомо - лизосомального слияния, устойчивость к действию лизосомальных ферментов);
- способность вызывать выраженную реакцию ГЗТ, выявляемую с помощью туберкулиновой пробы - “ГЗТ туберкулинового типа”.
Антигенная структура. Микобактерии туберкулеза имеют сложный и мозаичный набор антигенов. В антигенном отношении M.tuberculosis имеет наибольшее сходство с M.bovis и M.microti. Имеются перекрестно - реагирующие антигены с коринебактериями, актимомицетами. Для идентификации микобактерий антигенные свойства практически не используют.
Эпидемиология. Основными путями заражения являются воздушно - капельный и воздушно - пылевой. Основным источником заражения является больной туберкулезом человек. Особую роль имеет скученность проживания, в России наибольшую значимость имеют места заключения, лагеря беженцев, лица без определенного места жительства и другиен социально ущербные группы населения. В относительно небольшом проценте случаев туберкулез обусловлен заражением от животных (чаще - через молоко) М.bovis.
Патогенетические особенности.
В течение жизни человек неоднократно контактирует с микобактериями туберкулеза, однако туберкулезный патологический процесс развивается далеко не у всех инфицированнных. Это зависит от многих факторов и прежде всего - резистентности организма.
Наиболее часто заражение происходит через дыхательные пути. Попавшие в организм микобактерии захватываются альвеолярными и легочными макрофагами. В месте попадания может развиться первичный аффект (бронхопневмонический фокус). Далее возбудитель транспортируется в регионарные лимфоузлы, вызывая воспалительную реакцию - лимфангоит и лимфаденит. Первичный аффект, лимфангоит и лимфаденит - первичный комплекс (первичный очаг туберкулеза), характеризующийся образованием по ходу лимфатических путей и узлов гранулем в виде бугорков (бугорчатка или туберкулез).
Образование гранулем представляет собой клеточную реакцию ГЗТ на ряд химических компонентов микобактерий. В центре гранулемы в очаге некроза (казеозного распада) находятся микобактерии. Очаг окружен гигантскими многоядерными клетками Пирогова - Лангханса, их окружают эпителиоидные клетки а по периферии - лимфоциты, плазматические и мононуклеарные клетки.
Исходы первичного очага:
- при достаточной резистентности организма размножение возбудителя в гранулемах прекращается, очаг окружается соединительнотканной капсулой и обезизвествляется (откладываются соли кальция). Этот процесс определяется формированием нестерильного инфекционного иммунитета к возбудителю туберкулеза. Нестерильность - способность микобактерий длительно сохраняться в первичном очаге и ждать свой час (иногда через несколько десятилетий);
- при недостаточной резистентности - усиленный казеозный распад очага, казеозная пневмония, тяжелая первичная легочная чахотка и генерализованный туберкулез (диссеминированный или милиарный туберкулез с гранулемами в различных органах).
Вторичный туберкулез.Вторичный туберкулезный процесс - реактивация возбудителя в результате ослабления резистентности наблюдается при стрессах, нарушениях питания и у лиц пожилого возраста. Возникают очаги казеозного распада в легких с образованием полостей, поражение бронхов, мелких кровеносных сосудов.
Иммунитет. В основе нестерильного инфекционного и вакцинального иммунитета при туберкулезе - клеточный иммунитет в виде гиперчувствительности замедленного типа (ГЗТ), опосредуемой Т- лимфоцитами и макрофагами. Т- лимфоциты при участии белков главной системы гистосовместимости класса I распознают клетки, инфицированные микобактериями туберкулеза, атакуют и разрушают их. Антибактериальные антитела связываются с различными антигенами возбудителя, образуют циркулирующие иммунные комплексы (ЦИК) и способствуют их удалению из организма.
Аллергическая перестройка (ГЗТ) к туберкулезной палочке свидетельствует о формировании приобретенного иммунитета и может быть выявлена с помощью туберкулиновой пробы. Эта проба является достаточно специфичной. Старый туберкулин Коха представляет концентрированный фильтрат стерилизованных компонентов микобактерий. Очищенный препарат PPD (новый туберкулин Коха, содержащий туберкулопротеины) используют преимущественно для постановки внутрикожной пробы Манту. С помощью этой пробы проводят отбор лиц, подлежащих ревакцинации. Положительный результат пробы Манту нельзя рассматривать как обязательный признак активного процесса (это на самом деле показатель ГЗТ), а отрицательный - не всегда свидетельствует об его отсутствии (анергия, иммунодефициты).
Иммунопрофилактика включает внутрикожное введение аттенуированного штамма B.bovis, известного как бацилла Кальметта - Жерена (БЦЖ). В России вакцинацию проводят новорожденным (на 5-7 дни жизни), ревакцинацию - в 7-12-17-22 лет и более старших возрастах при отрицательной пробе Манту (т.е. отсутствии клеточного нестерильного = вакцинального или инфекционного иммунитета - ГЗТ).
Лабораторная диагностика. Применяют микроскопические, бактериологические, биологические, аллергологические, серологические и молекулярно - генетические методы.
Микроскопическая диагностика включает микроскопию нативного материала, использование методов накопления, люминесцентную диагностику. Микроскопия нативного патологического материала (мокрота, отделяемое свищей, промывные воды из бронхов, моча) в мазках, окрашенных по Цилю - Нильсену, позволяет выявлять красные кислотоустойчивые палочки при концентрации микобактерий не менее нескольких сот тысяч / мл. Методы накопления (например, флотации) повышают чувствительность микроскопии до нескольких тысяч микробных тел / мл. Люминесцентная микроскопия с использованием акридинового оранжевого или аурамина - родамина - наиболее чувствительный и эффективный метод бактериоскопии, чувствительность - 500-1000 микобактерий / мл. Позволяет выявлять микобактерии с измененными культуральными и тинкториальными свойствами.
Бактериологический метод (посев на питательные среды) позволяет обнаружить микобактерии при концентрации 200-300 / мл. Наиболее эффективен до или в начале лечения, в конце лечения уступает по эффективности люминесцентному методу. Недостаток - длительность получения результатов - от 2 до 12 недель. Достоинство - возможность оценки вирулентности культуры, определение чувствительности к лекарственным препаратам. Разработаны ускоренные методы выделения. По методу Прайса материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду с цитратной кровью. Стекло вынимают через 3-4 суток и окрашивают по Цилю - Нильсену.
Золотой стандарт - биологическая проба на морских свинках, позволяет определять до 10 микобактерий в мл. Распространение резистентных и измененных микобактерий снизило чувствительность метода. Метод требует соблюдения режимных условий и применяется в крупных специализированных лабораториях.
Аллергологические методы - это широко используемые кожные пробы с туберкулином и методы аллергодиагностики in vitro (РТМЛ, ППН - показатель повреждения нейтрофилов и др.).
Серологические методы многочисленны (РСК, РА, РПГА), однако в связи с недостаточной специфичностью используют мало.
Наиболее совершенны генетические методы, в практических лабораториях их используют пока недостаточно.
M.bovis.
Этот вид микобактерий выявлен у 60 видов млекопитающих. Эпидемическую опасность для человека представляют крупный рогатый скот, реже - верблюды, козы, овцы, свиньи, собаки, кошки. Больные животные выделяют микобактерии с молоком, мокротой, экскрементами. Человек заражается при уходе за больными животными или употреблении сырого молока и молочных продуктов (в сыре и масле возбудитель может сохраняться более 200 дней). На долю этого возбудителя приходится до 5% случаев туберкулеза (высокая доля туберкулеза бычьего типа - в Якутии и других территориях с высоким уровнем заболеваемости животных туберкулезом).
M.leprae.
Микобактерии лепры - возбудитель лепры (проказы) - генерализованной хронической инфекции с преимущественным поражением производных эктодермы (покровные ткани и периферическая нервная система).
Морфология в целом типична для микобактерий. Хорошо окрашиваются по Цилю - Нильсену, облигатные внутриклеточные паразиты. В мазках располагаются параллельными группами (пачка сигар) или шаровидными скоплениями.
Культуральные свойства. Очень плохо культивируются на питательных средах. Основной метод диагностики - бактериоскопический. Дифференциация с микобактериями туберкулеза может осуществляться в биопробе на белых мышах (M.leprae не патогенна для них).
Эпидемиология. Заболевание мало контагиозно. Имеет значение генетическая предрасположенность, индивидуальная резистентность к инфекции. Заражение происходит контактно - бытовым и воздушно - капельным путем. Содержат больных в лепрозориях (основной путь профилактики - изоляция).
Клинико - патогенетические особенности. Инкубационный период - очень длительный (от 4-6 лет). Выделяют туберкулоидную (более доброкачественную) и лепроматозную (более тяжелую) форму.
Лечение длительное, иногда пожизненное. Основные препараты - сульфоны, препараты выбора - дапсон, рифампицин, клофазимин.
Лекция №6. Семейство Enterobacteriaceae. Род Salmonella.
Общая характеристика семейства энтеробактерий.
Бактерии этого семейства являются наиболее частыми возбудителями кишечных инфекций. Их объединяет ряд общих признаков. Это короткие, не образующие спор, палочки с закругленными концами, подвижные (перитрихи) или неподвижные, некоторые имеют капсулы. Аэробы или факультативные анаэробы. Характерна отрицательная окраска по Граму. Хорошо растут на обычных питательных средах с мясном экстрактом. На большинстве плотных сред энтеробактерии образуют круглые выпуклые блестящие S- (гладкие) колонии, а также часто обусловленные потерей капсулы плоские, неровные и зернистые R- (шероховатые) формы. Для них характерна ферментация глюкозы (и других углеводов) с образованием кислоты и газа. По отношению к лактозе их делят на лактоза- ферментирующие и лактоза - неферментирующие. Каталаза - положительны, восстанавливают нитраты в нитриты.
Семейство энтеробактерий включает более 20 родов, объединяющих более 100 видов бактерий, обитающих в почве, на растениях, входящих в состав микробных биоценозов кишечников животных и человека. Наибольшее значение для человека имеют рода Escherichia, Salmonella, Shigella, Yersinia, Proteus, Klebsiella и др. Для дифференциации родов используют в основном биохимические признаки, для классификации внутри родов и видов - изучение антигенной структуры (О-, Н- и К- антигенов).
О- антиген представлен липополисахаридами (ЛПС) наружной мембраны. Штаммы, лишенные О- антигена, образуют R- колонии и обычно авирулентны.
Н- антиген - термолабильные белки, имеются только у подвижных (имеющих жгутики) видов.
К- антиген - термостабильные полисахариды капсулы и наружной оболочки.
В патогенезе поражений, вызываемых энтеробактериями, имеют значение ЛПС (эндотоксин, освобождающийся при разрушении бактерий), различные энтеротоксины, факторы инвазивности и адгезии (жгутики и др.), ферменты патогенности.
Род Salmonella.
Сальмонеллы - большая группа энтеробактерий, среди которых различные серотипы - возбудители брюшного тифа, паратифов А, В и С и наиболее распространенных пищевых токсикоинфекций - сальмонеллезов. По признаку патогенности для человека сальмонеллы разделяют на патогенные для человека- антропонозы (вызывают брюшной тиф и паратифы А и В) и патогенные для человека и животных - зоонозы (вызывают сальмонеллезы). Несмотря на значительные различия сальмонелл по антигенным характеристикам, биохимическим свойствам, вызываемым ими заболеваниям, по современной, но недостаточно удобной и совершенной классификации выделяют два вида - S.bongori и S.enteritica. Последний разделен на подвиды, из которых наибольшее значение имеют подвиды choleraesuis и salamae. Подвид choleraesuis включает наибольшую часть известных сероваров сальмонелл (около 1400 из примерно 2400).
Антигенная структура. Выделяют О-, Н- и К- антигены. К группе К- антигенов относят Vi- антигены (антигены вирулентности). Благодаря более поверхностному расположению (чем О- антигены) Vi- антиген может препятствовать агглютинации культур сальмонелл О- специфической сывороткой (экранирование). Для дифференциации сальмонелл применяют схему (серологическую классификацию) Кауфманна - Уайта.
В соответствии со структурой О- антигенов сальмонеллы подразделяют на О- группы (67 серогрупп), в каждую из которых входят серологические типы, отличающиеся строением Н- антигенов. Принадлежность сальмонелл к определенному серовару устанавливают при изучении антигенной структуры в соответствии со схемой Кауфманна - Уайта. Примеры: серотип S.paratyphi A относится к серогруппе А, S.paratyphi В - к серогруппе В, S.paratyphi С - к группе С, S.typhi - к серогруппе D.
Факторы патогенности.
1.Факторы адгезии и колонизации.
2. Способность к внутриклеточному паразитированию, препятствовать фагоцитозу, размножаться в клетках лимфоидной ткани выражены у возбудителей брюшного тифа, паратифов А и В, способствуя хроническому носительству.
3.Эндотоксин (ЛПС).
4. Термолабильные и термостабильные энтеротоксины.
5. Цитотоксины.
6. Существенное значение имеют плазмиды вирулентности и R- плазмиды.
7. Vi - антиген ингибирует действие сывороточных и фагоцитарных бактериоцидных факторов.
Основными факторами патогенности сальмонелл является их способность проникать в макрофаги и размножаться в лимфоидных образованиях собственно слизистого слоя тонкого кишечника (пейеровы бляшки, солитарные фолликулы), а также продукция эндотоксина.
Патогенез поражений. Различия клинических форм заболеваний, вызываемых сальмонеллами, зависит от вирулентности и дозы возбудителя и состояния иммунной системы организма. Обычная доза, вызывающая клинические проявления - 106 - 109 бактерий, меньшая доза достаточна при иммунодефицитах, гипохлоргидрии и других заболеваниях желудочно - кишечного тракта.
Выделяют следующие основные формы сальмонеллезной инфекции:
- гастроинтестинальную;
- генерализованную (тифоподобный и септикопиемический варианты);
- бактерионосительство (острое, хроническое, транзиторное).
Существенные патогенетические особенности инфекционного процесса, вызываемого серотипами S.typhi, S.paratyphi A,B, являются основанием для выделения тифо- паратифозных заболеваний в самостоятельную нозологическую группу. Каждой фазе патогенеза соответствует клинический период заболевания и своя тактика лабораторного обследования. Основные фазы - внедрения возбудителя (соответствует инкубационному периоду), первичной локализации возбудителя (продромальный период), бактеремии (первая неделя заболевания), вторичной локализации сальмонелл (разгар заболевания - 2-3 недели), выделительно- аллергическая (реконвалесценция - 4 неделя заболевания).
Проникшие через рот сальмонеллы попадают в эпителиальные клетки двенадцатиперсной и тонкой кишки посредством эндоцитоза. Они легко проникают в эпителиальные клетки, но не размножаются здесь, а проходят и размножаются в лимфатическом аппарате тонкого кишечника. Сальмонеллы размножаются преимущественно в lamina propria (первичная локализация), что сопровождается местной воспалительной реакцией слизистой оболочки, притоком жидкости в очаг поражения и развитием диарейного синдрома (гастроэнтерит). Энтеротоксины повышают уровень циклического аденомонофосфата (цАМФ), происходит повышение уровня гистамина и других биологически активных веществ, проницаемости сосудов. Наблюдаются водно - электролитные нарушения, развиваются гипоксия и ацидоз, которые усугубляют патологический процесс с преобладанием сосудистых растройств. Происходит разрушение части сальмонелл с выделением эндотоксина, сенсибилизация (ГЗТ) лимфатического аппарата тонкого кишечника.
Из слизистой оболочки сальмонеллы могут попадать в лимфо- и далее в кровоток, вызывая бактеремию. В большинстве случаев она носит транзиторный характер, т.к. сальмонеллы элиминируются фагоцитами.
В отличие от других сальмонелл, возбудители брюшного тифа и паратифов, проникнув в кровоток, способны выживать и размножаться в фагоцитах. Они могут размножаться в мезентериальных лимфоузлах, печени и селезенке и вызывать генерализацию процесса. После гибели фагоцитов сальмонеллы вновь поступают в кровь. При этом Vi- антиген ингибирует бактерицидные факторы.
При гибели сальмонелл освобождается эндотоксин, угнетающий деятельность центральной нервной системы (тиф - от греч. typhos - туман, спутанное сознание) и вызывающий длительную лихорадку. Действие эндотоксина может вызвать миокардит, миокардиодистрофию, инфекционно - токсический шок.
В результате бактеремии происходит генерализованное инфицирование желчного пузыря, почек, печени, костного мозга, твердых мозговых оболочек (вторичная локализация сальмонелл). Происходит вторичная инвазия эпителия кишечника, особенно пейеровых бляшек. В сенсибилизированной сальмонеллами стенке развивается аллергическое воспаление с образованием основного грозного осложнения - брюшнотифозных язв. Наблюдается длительное носительство сальмонелл в желчном пузыре с выделением возбудителя с испражнениями, пиелонефриты, кровотечения и перфорации кишечника при поражении пейеровых бляшек. Затем происходит формирование постинфекционного иммунитета, элиминация возбудителя и заживление язв или формирование бактерионосительства (в Западной Сибири часто на фоне хронического описторхоза).
Возбудителями сальмонеллезов являются другие серотипы сальмонелл, патогенные для человека и животных (S.typhimurium, S.enteritidis, S.heldelberg, S. newport и другие). В основе патогенеза сальмонеллезов - действие самого возбудителя (его взаимодействия с организмом хозяина) и эндотоксина, накапливающегося в пищевых продуктах, инфицированных сальмонеллами. В классическом варианте сальмонеллезная токсикоинфекция - гастроэнтерит. Однако при прорыве лимфатического барьера кишечника могут развиваться генерализованные и внекишечные формы сальмонеллезов (менингит, плеврит, эндокардит, артрит, абсцессы печени и селезенки, пиелонефрит и др.). Увеличение генерализованных и внекишечных форм сальмонеллезов связано с увеличением количества иммунодефицитных состояний, что имеет особое значение при ВИЧ- инфекции.
Отдельную проблему представляют госпитальные штаммы сальмонелл (чаще отдельные фаговары S.typhimurium), вызывающие вспышки внутрибольничных инфекций преимущественно среди новорожденных и ослабленных детей. Они передаются преимущественно контактно- бытовым путем от больных детей и бактерионосителей, обладают высокой инвазивной активностью, часто вызывая бактеремию и сепсис. Эпидемические штаммы характеризуются множественной лекарственной устойчивостью (R- плазмиды), высокой резистентностью, в том числе к действию высоких температур.
Эпидемиологические особенности. Характерно повсеместное распространение. Основные резервуары сальмонелл - человек (возбудители брюшного тифа и паратифа А) и различные животные (остальные серотипы сальмонелл). Основные возбудители отличаются полипатогенностью. Основные источники заражения - мясные и молочные продукты, яйца, птице- и рыбопродукты. Основные пути передачи - пищевой и водный, реже - контактный. Характерна чрезвычайная множественность резервуаров и возможных источников инфекции. Основное значение имеют сельскохозяйственные животные и птицы.
Лечение - антибиотики (левомицетин и др.). Часто выявляют резистентные к антибиотикам штаммы. Необходимо определять антибиотикорезистентность выделенных культур.
Специфическая профилактика может применяться преимущественно в отношении брюшного тифа. Применяют химическую сорбированную брюшнотифозную моновакцину. Вакцинацию в настоящее время применяют преимущественно по эпидемическим показаниям.
Дата добавления: 2014-12-17; просмотров: 1221;
