Как видно, процессы при нарушении анодного покрытия не меняются
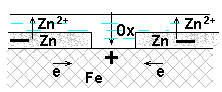
При повреждении анодного покрытия возникает коррозионный ГЭ, в котором основной материал -катод → не растворяется, на нем выделяется водород или поглощается кислород, а материал покрытия – анод →разрушается.
Задача 11. Для Аg/Br2 гальванического элемента:
-составьте уравнения анодной, катодной и токообразующей реакций;
- рассчитайте максимальную теоретическую величину энергии элемента (Вт∙ч) при уменьшении массы анода в результате анодной реакции на 1 грамм (при стандартных состояниях веществ и 298 К).
- объясните, почему напряжение элемента меньше рассчитанной Вами стандартной ЭДС, покажите ход поляризационных кривых и предложите условия, позволяющие увеличить напряжение;
Решение. Так как Е0Ag < Е0Br2, анод –серебряный электрод. Уравнения процессов, протекающих на аноде и катоде в работающем Аg/Br2 ГЭ и уравнение токообразующей реакции:
А: 2Аg → 2Аg+ + 2е - окисление
К: Br2 + 2е → 2Br - - восстановление
ТОР: 2Аg + Br2 ↔ 2Аg+ + 2Br -
Рассчитываем Е0Э ГЭ при с.с. и 298 К:
Е0Э = Е0К - Е0А = Е0 Br2 /Br - - Е0 Аg+/Аg = 1,065 - 0,799 = 0,266 В.
Максимальная теоретическая энергию ГЭ, которую он может отдать при разряде и потере массы анода в 1 грамм равна: W = QE0Э (где Q -
максимальное количество электричества, которое может отдать элементА∙ч). Q находим из следствия 2 закона Фарадея:
Q = (m /MЭ)∙(F /1) = (1 г ∙26,8 А∙ч /108 г/м э ∙1м э) = 0, 248 А∙ч
W= 0, 248 А∙ч ∙ 0,266 В= 0,066 Вт∙ч.
Равновесные потенциалы электродов и ЭДС могут быть определены в условиях отсутствия тока в цепи. В работающем ГЭ при прохождении электрического тока уменьшается концентрация исходных реагентов и увеличивается концентрация продуктов реакции : потенциал анода становится менее отрицательным, потенциал катода – менее положительным( поляризация электродов). Помимо этого возникают омические потери. В результате напряжение гальванического элемента меньше ЭДС:
U = ЕЭ - I .R -DЕА -DЕК ,
Изменение потенциалов электродов под действием тока отражают поляризационные кривые: 
Для увеличения напряжения гальванического элемента Аg/Br2 можно:
- Снизить поляризацию электродов. Для этого обеспечить постоянный подвод реагентов (Br2), отвод продуктов реакции (Br- и Аg+); обеспечить перемешивание раствора; применить катализатор; повысить температуру; повысить площадь поверхности электродов (пористые, гофрированные электроды).
- Уменьшить сопротивление системы путем сближения анода и катода, применением проводников с низким сопротивлением.
Задача12.Для водного раствора Fe(NO3)2:
1) составьте уравнения электродных процессов, протекающих на Pt -электродахпри электролизе;
2) рассчитайте напряжение разложения при 298К; объясните, почему напряжение, подаваемое на электролизёр больше напряжения разложения, предложите условия, которые позволят уменьшить подаваемое напряжение;
3) рассчитайте массу (г) металла, восстановленного на катоде (S=1м2) при пропускании через электролизёр тока, силой 12A в течение 3 часов и выходе металла по току , равном70%
Дата добавления: 2014-11-29; просмотров: 1933;
