Процесс устранения поляризации - деполяризация
ЦельÞ увеличить U Þ для этого необходимо:
1. Увеличить ЭДС;
2. Уменьшить поляризацию;
3. уменьшить потери, для чего: а)уменьшить I; b )уменьшить r1 и r2 – за счет уменьшения расстояния между электродами, использовать добавки увеличивающие электропроводность электролита.
Электролиз
-это ОВР, протекающие на электродах под действием постоянного электрического тока от внешнего,процесс превращения электрической энергии в химическую.
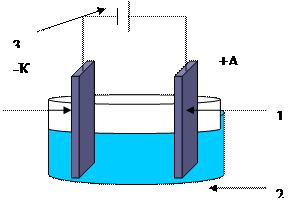
Электролизер–прибор, в котором
происходит электролиз:
1-катод «-», анод «+»,
2 – электролит,
3 - источник постоянного тока
Схема электролизера
Электроды:
· Инертные(неактивные): Pt-металлы, C, Аи, PbО2, RuO, нерж. сталь -
не растворяются.
· Активные:все М электроды. Они растворяются на аноде: М→ Мn+ + nе.
Металлы, переходящие в определенной среде в неактивное состояние, т.е. пассивирующиеся,благодаря образованию защитной пленки (оксидов, гидроксидов, солей) на поверхности: алюминий, никель, хром, титан, тантал и нек. др.)
Электролиз подчиняется законом Фарадея и кинетическим законам. Для принудительного процесса (не протекающего самопроизвольно в прямом направлении):
Аmin приложенная к системе= DG; DG = nFUmin ; Umin = Еа - EK при i=0.
Потенциал разложения или выделения:минимальное напряжение, при котором процесс электролиза становится возможным.
Под действием тока потенциалы электродов электролизера изменяютcя– поляризация: ЕК – более отрицательным, ЕА – более положительным.
Клемовое напряжение(напряжение электролизера) вследствие поляризации и омических потерьувеличивается с увеличением i:
Uкл=Umin + ∆EA + ∆EK + I(R1+R2)
Увеличение Uкл приводит к перерасходу энергии по сравнению с рассчитанной по уравнениям химической термодинамики. Для уменьшения Uкл следует:
1. Уменьшить омические потери:
- использовать электролит с высокой электропроводностью
-уменьшить расстояние между электродами
- увеличитьТ;
2. Уменьшить концентрационную и электрохимическую поляризации:
- увеличить Sэлектродов и Т; изменить Среагента ;
- перемешивать;
- использовать электроды-катализаторы;
- уменьшить ток
Электролиз расплава КОН (сильный электролит)
Ионный состав расплава: KOH → K+ + OH-
Электроды: графит С - инертный
 К: K+ + e → K0 (Bi=100%)
К: K+ + e → K0 (Bi=100%)
 А: 4OH- → O2↑ + 2H2O + 4e (Bi=100%)
А: 4OH- → O2↑ + 2H2O + 4e (Bi=100%)
Электролиз водных растворов
Последовательность протекания электродных процессов зависит от состава электролита, материала электрода, рН, величины поляризации.
Электролиз в условиях конкуренции
Правила катодного восстановления
На катоде
ü в первую очередь восстанавливаются наиболее сильные окислители, т.е. идет реакция с более + Е
ü если разница потенциалов частиц в приэлектродном слое меньше 1В, возможны два и более процесса.
При электролизе окислители делятся на три группы:

Потенциал водорода зависит от рН (уравнение Нернста)
Правила анодного окисления
Дата добавления: 2014-12-03; просмотров: 1554;
