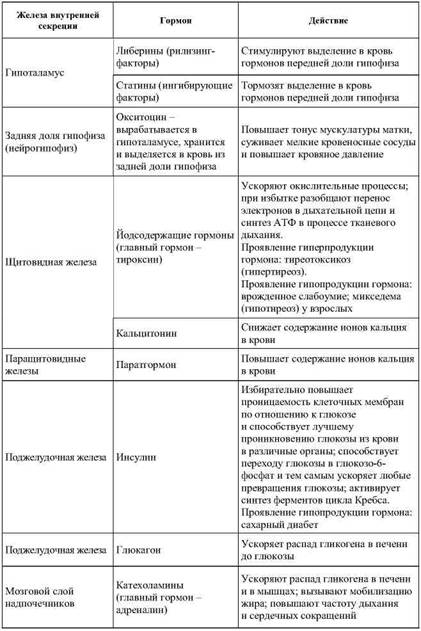
Краткая характеристика отдельных гормонов
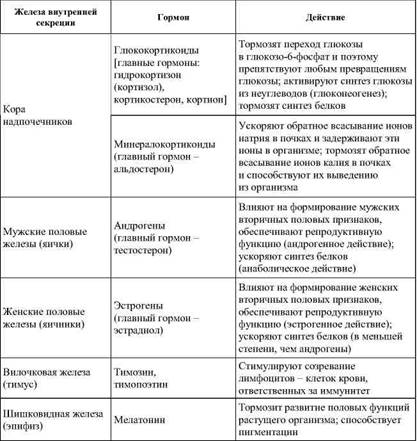
Окончание табл. 27
Чувствительность рецепторов и активность ферментов, расщепляющих гормоны, может меняться при нарушениях обмена, изменениях физико-химических параметров организма (температура, кислотность, осмотическое давление), концентрации важнейших субстратов, при выполнении мышечной работы, заболеваниях, введении лекарственных средств. Следствием этого является усиление или ослабление влияния гормонов на соответствующие органы.
Механизмы действия гормонов разнообразны, среди них можно выделить главные, присущие большинству гормонов:
1) гормоны влияют на скорость синтеза ферментов, ускоряя или замедляя его: в органах-мишенях повышается или снижается концентрация определенных ферментов, изменяя скорость ферментативных реакций;
2) гормоны влияют на активность ферментов в этих органах, являясь:
– активаторами ферментов – скорость ферментативных реакций повышается;
– ингибиторами ферментов – скорость ферментативных реакций снижается;
3) гормоны влияют на проницаемость клеточных мембран в отношении определенных химических соединений: в клетки поступает больше или меньше субстратов для ферментативных реакций, что тоже обязательно сказывается на скорости химических процессов.
Таким образом, основные действия гормонов направлены на регуляцию скорости химических реакций в клетках и оказывают влияние на физиологические функции.
По химическому строению гормоны делятся на группы.
Гормоны белковой природы (белки и полипептиды):
– гормоны гипоталамуса,
– гормоны гипофиза,
– кальцитонин щитовидной железы,
– гормон паращитовидных желез,
– гормоны поджелудочной железы.
Гормоны – производные аминокислоты тирозина:
– йодсодержащие гормоны щитовидной железы,
– гормоны мозгового слоя надпочечников.
Гормоны стероидного строения:
– гормоны коры надпочечников,
– гормоны половых желез.
Синтез и выделение гормонов в кровь находятся под контролем нервной системы. В упрощенном виде взаимосвязь между эндокринной и нервной системами можно представить следующим образом. При воздействии на организм каких-либо внешних факторов или же при возникновении изменений в крови и в различных органах соответствующая информация передается по чувствительным нервам в гипоталамус (орган ЦНС). В ответ на полученную информацию вырабатываются гормоны гипоталамуса, которые затем поступают в гипофиз и стимулируют или тормозят в нем секрецию гормонов передней доли гипофиза. Гормоны выделяются из гипофиза в кровь, переносятся в железы внутренней секреции и вызывают в них синтез и секрецию соответствующих гормонов, которые далее воздействуют на органы-мишени. Таким образом в организме осуществляется единая нервно-гормональная, или нейрогуморальная, регуляция.
В частности, регуляция обмена углеводов может быть представлена следующим образом (в основе лежит саморегуляция).
Концентрация глюкозы в периферической крови относится к биологическим константам, т е. величинам, колебания которых не должны превышать определенные гомеостатические нормы. У здорового человека содержание глюкозы в состоянии относительного покоя находится в пределах 4,5-5,5 ммоль/л (80-120 мг%). Повышение уровня глюкозы выше 5,5 ммоль/л называется гипергликемией, падение ниже 3,3 ммоль/л – гипогликемией. От избыточных потерь глюкозы организм предохраняет функция почек: глюкоза, профильтровавшаяся в первичную мочу, реабсорбируется из почечных канальцев в кровь, если только ее содержание в крови не превышает 8,5 ммоль/л. Наличие глюкозы в моче называется глюкозурией.
Это означает, что более или менее значительное отклонение концентрации глюкозы в крови от нормальных пределов возбуждает механизмы, под влиянием которых происходит ее нормализация. Рассмотрим эти механизмы саморегуляции на примере гипогликемии, гипергликемии.
Ведущая роль в контроле содержания глюкозы в крови принадлежит гипоталамусу. Возбуждение гипоталамических центров приводит к активированию физиологических механизмов, способствующих нормализации уровня глюкозы в крови. К ним относятся возбуждение симпатического отдела нервной системы и усиление секреции катехоламинов мозговым слоем надпочечников, повышение продукции глюкагона а-клетками поджелудочной железы, а также активирование гипоталамических либеринов, под влиянием которых вырабатываются кортикотропин, глюкокортикоиды и соматотропин.
Гипогликемия – мощный стимулятор для усиления секреции катехоламинов и глюкагона. Катехоламины (адреналин, норадреналин и дофамин) попадают в периферическую кровь, где связываются с белком и циркулируют в связанном виде. Свободные катехоламины быстро разрушаются под влиянием ферментов. Катехоламины оказывают влияние на органы мишени через специфические адренорецепторы.
Для регуляции уровня глюкозы в крови преимущественное значение имеет адреналин. Он активирует распад гликогена в печени и мышцах. Влияние на гликоген осуществляется через фосфорилазы. В печеночных клетках при этом образуется избыток глюко-зофосфатов, а затем – свободной глюкозы, которая поступает в кровь и противодействует гипогликемии. В мышцах под влиянием адреналина происходит распад гликогена до глюкозы и молочной кислоты, которые частично захватываются гепатоцитами, и восполняются запасы гликогена.
Определенное влияние, схожее с адреналином, оказывает норад-реналин надпочечников и симпатических нервов. Однако интенсивность его влияния на углеводный обмен значительно меньше.
Секрецию глюкагона стимулирует гипогликемия, а также уменьшение содержания в крови жирных кислот и аминокислот. Существенное тормозящее влияние на секрецию глюкагона оказывает соматостатин, вырабатываемый в эндокринной части поджелудочной железы. Симпатический отдел нервной системы активирует секрецию глюкагона. Это создает дополнительный стимул для выделения его при гипогликемии. Ответная секреция глюкагона при значительном снижении уровня глюкозы в крови происходит быстро и в значительных пределах (в 4-5 раз).
Глюкагон оказывает выраженное гипергликемическое действие, которое делят на две фазы. Первая фаза – гликогенолиз, в основе которого лежит активирование фосфорилазы; т е. аналогично действию адреналина. Однако, в отличие от адреналина, глюкагон не действует на гликоген мышц, поэтому не вызывает повышения содержания молочной кислоты в крови. Первая фаза непродолжительна и зависит от количества гликогена, резервированного в печени. Вторая фаза гипергликемии – четкое влияние глюкагона обусловлено глюконеогенезом, т. е. новообразованием глюкозы из неуглеводных соединений. Эта фаза характеризуется менее высоким, но более длительным повышением концентрации глюкозы в крови.
Кортикотропин – глюкокортикоиды. Возбуждение гипоталамических нейросекреторных клеток при гипогликемии охватывает центры продукции кортиколиберина. По существу, значительное уменьшение уровня всегда является острым стрессом. Увеличенное образование и выделение в портальную систему гипофиза кортиколиберина неминуемо приводит к активированию секреции кортикотропина из передней доли гипофиза, а под влиянием кортикотропина стимулируется биосинтез глюкортикоидов в коре надпочечных желез. Основной глюкокортикоид человека – кортизол, который активно усиливает распад белка (кроме печени) и усиливает новообразование углеводов из неуглеводных компонентов. Главным субстратом глюконеогенеза служат аминокислоты, освобождающиеся из белков различных органов под влиянием тех же глюкокортикоидов. В результате в печени увеличивается количество гликогена, который поставляет глюкозу в кровь. Как видно, в отношении глюконеогенеза глюкокортикоиды действуют синергично (однонаправленно) с глюкагоном.
Соматотропин. Гипогликемия – мощный стимулятор секреции соматотропина. Его гипергликемическое действие объясняется уменьшением потребления глюкозы периферическими тканями. Следует также помнить, что анаболическое влияние соматотропина в белковом обмене требует участия инсулина, поэтому его длительная повышенная секреция приводит к истощению инсулина.
Саморегулирование четко выражено и при гипергликемических состояниях. Наиболее мощным фактором, противодействующим повышению уровня глюкозы в крови, является инсулин. Глюкоза – специфический стимулятор секреции этого гормона. Синтез инсулина происходит в (3-клетках поджелудочной железы. Вначале на рибосомах образуется препроинсулин – одиночный пептид из 104—110 аминокислотных остатков. По мере дальнейшего прохождения по шероховатой эндоплазматической сети часть молекулы отщепляется и остается проинсулин из 81-86 аминокислотных остатков. В результате этого расщепления образуются инсулин, частично расщепленный проинсулин и С-пептид (часть молекулы препроинсулина). Все эти гормональные формы депонируются в секреторных гранулах (3-клеток путем полимеризации и комплек-сирования с цинком. В ответ на гипергликемию происходит двухфазное выведение гормона: первая быстрая (в течение 1 мин после действия стимула) и вторая – спустя 20-30 мин. В первой фазе секретируется инсулин, расположенный вблизи цитоплазматичес-кой мембраны, а во второй фазе происходит транспорт гранул инсулина по системе микротрубочек и микрофиламентов от аппарата Гольджи до цитоплазматической мембраны. Лишь затем гормон выводится из (3-клетки. Опосредуют влияние глюкозного стимула АМФ, метаболиты глюкозы и Са2 .
Поступивший в кровь инсулин циркулирует в двух формах – свободной и связанной с белками. Свободный инсулин действует на мышцы, жировую ткань, печень и мозг, а связанный – только на жировую ткань. Между связанным и свободным инсулином имеется динамическое равновесие: при гипергликемии увеличивается количество свободной фракции и уменьшается количество связанного гормона, а при недостатке глюкозы преобладает связанный инсулин.
Усилению секреции инсулина способствуют также соматотропин, кортикотропин, глюкокортикоиды, т е. гормоны с гипергликемическим эффектом.
Инсулин – единственный сахаропонижающий гормон, влияние его многопланово. Он вызывает повышение проницаемости цитоплазматических мембран клеток-мишеней к моносахаридам, особенно к глюкозе. В печени инсулин активирует глюкокиназу, в связи с чем возрастает количество глюкозо-6-фосфата, соответственно усиливается метаболизм углеводов. В печени наиболее интенсивно происходит глюкогенез, поэтому увеличивается содержание гликогена. Инсулин подавляет также распад печеночного гликогена (гликогенолиз), а также тормозит глюконеогенез. Наконец, инсулин способствует превращению углеводов в жиры и в конечном итоге определяет анаболические процессы в организме.
Все железы внутренней секреции функционируют согласованно и оказывают друг на друга взаимное влияние. Введение в организм извне гормонов не только сказывается на функции железы, вырабатывающей вводимый гормон, но и может оказать негативное воздействие на состояние всей нервно-гормональной регуляции в целом.
Неквалифицированное вмешательство в регуляцию этой сложной системы оказывает негативное влияние на функции всего организма. Поэтому использование гормональных препаратов в качестве допингов опасно для здоровья спортсменов.
Только специалисты могут грамотно провести коррекцию гормонального статуса: эндокринолог, андролог, гинеколог-эндокринолог (см. «Актуальные проблемы женского спорта»).
При подозрении на сбои в работе какой-либо железы внутренней секреции необходимо детально исследовать ее функции. Контроль за уровнем глюкозы (а значит, косвенно, и за работой инсу-лярного аппарата) до нагрузки и во время нагрузки стал рядовым фактом. Уровень развития современного спорта настоятельно требует введения, также, в повседневную практику исследований уровня гормонов щитовидной железы, половых гормонов.
Кроме того, долгие годы существовало убеждение, что выделение кодируемой информации является спецификой тканей эндокринной системы. В настоящее время в этой области науки достигнут значительный прогресс, свидетельствующий о том, что практически все ткани участвуют во взаимном обмене информацией между собою, а число химических сигналов, выделяемых тканями и кодирующих передаваемую информацию, намного превосходит число известных гормонов.
Дата добавления: 2015-01-02; просмотров: 4646;
