Промышленные процессы термической переработки нефти и нефтяных фракций
1. Лохматов Г.И. Элементы строения залежей нефти и газа: Методические указания для практических занятий. – Иркутск. Изд-во ИГУ, 2004. – 32 с.
Лохматов Г.И. Геология и геохимия нефти и газа: Методические указания по курсовой работе. – Иркутск. Изд-во ИГУ, 2004. – 20 с.
ТЕРМИЧЕСКИЕ И КАТАЛИТИЧЕСКИЕ ПРЕВРАЩЕНИЯ КОМПОНЕНТОВ НЕФТИ И ГАЗА
Промышленные процессы термической переработки нефти и нефтяных фракций
Нефть представляет собой сложную смесь, в состав которой входит большое количество различных углеводородов, кислород-, серо- и азоторганических веществ, а также смолисто-асфальтеновые вещества, микроэлементы и минеральные компоненты. В промышленности применяется не сырая нефть, а продукты ее переработки.
Основными промышленными процессами термической переработки нефтяного сырья являются термический крекинг, пиролиз и коксование. В зависимости от условий проведения термического процесса сырье находится в различных агрегатных состояниях: пиролиз протекает как газофазная реакция, коксование нефтяных остатков происходит в жидкой фазе, при термическом крекинге тяжелого сырья возможно сосуществование газовой и жидкой фаз.
Закономерности термического разложения углеводородов в определенной мере изменяются при переходе от условий термического крекинга (470…540 °С) к условиям пиролиза (700…1000 °C). Температура влияет на механизм процесса и на состав продуктов.
Реакции, протекающие при пиролизе и крекинге, можно разделить на три основные группы:
1) первичные реакции разрыва углеродной цепи и дегидрирования, приводящие к образованию алкенов, изомеризация и циклизация;
2) вторичные реакции превращения алкенов – полимеризация и конденсация;
3) реакции прямого молекулярного распада, при котором образуются пиро-
углерод, водород и частично ацетилен.
Термический крекинг.Этотпроцесс применяют в промышленности с 1912 г. Первоначально его использовали для получения автомобильного бензина, однако из-за возросших требований к качеству моторного топлива к 1960-м годам он был полностью вытеснен каталитическим крекингом.
В настоящее время термический крекинг тяжелых остатков переработки нефти проводят с целью получения вакуумного газойля (термогазойля) или маловязкого котельного топлива – мазута (или крекинг-остатка).
Существуют разнообразные виды термического крекинга. Термический крекинг, направленный преимущественно на снижение вязкости котельного топлива, получил в мировой практике название висбрекинг (легкий крекинг). Его осуществляют при температуре 450…480 °С под давлением 2 – 5 МПа. Сырьем для висбрекинга служат нефтяные остатки – полугудроны, гудроны, асфальты, экстракты, тяжелые газойли каталитического крекинга. В процессе легкого крекинга происходит частичное удаление нестабильных серосодержащих соединений (сероводорода, сульфидов, дисульфидов). В настоящее время висбрекинг является одним из перспективных процессов глубокой переработки высоковязких нефтяных остатков. Включение его в схему переработки нефти позволяет значительно увеличивать отбор вакуумного газойля и получать товарное котельное топливо без применения разбавителей.
Основные продукты висбрекинга – углеводородный газ, крекинг-бензин, керосино-газойлевая фракция, термогазойль и крекинг-остаток.
Газ термического крекинга, представленный главным образом углеводородами C1—С3, содержит значительное количество непредельных углеводородов; его применяют в качестве нефтехимического сырья и как топливо.
Крекинг-бензин (температура кипения до 140 оС) также содержит много алкенов, вследствие чего он характеризуется низкой химической стабильностью. Наличие сернистых и азотистых соединений, невысокое октановое число
(60 – 66) не позволяют использовать крекинг-бензин в качестве компонента моторного топлива без предварительной гидроочистки.
Керосино-газойлевая фракция (температура кипения 200…350 °С) является ценным компонентом мазута. После гидроочистки ее применяют также как компонент дизельного топлива.
Термогазойль (температура кипения > 350 °С) – сырье для каталитического крекинга, гидрокрекинга и производства технического углерода. Крекинг-остаток используют как котельное топливо.
В последнее время развиваются процессы термического крекинга тяжелых очищенных дистиллятов нефти, главной целью которых является получение не бензина, а крекинг-остатка с низким содержанием асфальтенов и металлов, пригодного для получения игольчатого кокса (кокс высокой степени чистоты и механической прочности, применяется для изготовления электродов при производстве стали и алюминия).
Пиролиз. Данный процесс используется для получения газообразных олефинов, главным образом этилена. Сырьем для пиролиза является бензин прямой перегонки, керосино-газойлевые фракции, а также природные и попутные газы. Пиролиз протекает при давлении ~0,1 МПа и температуре 700…900 °С.
В условиях высоких температур пиролиза возрастает концентрация радикалов. Это приводит к уменьшению длины цепи и увеличению роли радикально-нецепного разложения, при котором отдельные углеводороды разлагаются независимо друг от друга. (Термические превращения углеводородов при высоких температурах приведены в подпункте 1.1.1.)
Повышение температуры ускоряет реакции с более высокими значениями энергии активации, вследствие чего меняется соотношение между различными реакциями радикалов, возрастает значение более энергоемких реакций распада радикалов по сравнению с менее энергоемкими реакциями присоединения.
Для снижения парциального давления углеводородов сырье обычно разбавляют водяным паром.
Оптимальным сырьем для производства этилена является этан. Выход этилена при этом достигает 80 %. Значительный выход этилена наблюдается также при пиролизе алканов нормального строения: из пропана – до 48 %, из бутана – 45 %.
При пиролизе разветвленных алканов образуются преимущественно алкены состава С3–С4 и алкадиены, при высокой температуре образуются также аллен и метилацетилен. Выход низших алкенов при пиролизе циклоалканов и аренов невелик.
Важнейшим фактором при выборе сырья для пиролиза является доступность, что в разных странах определяется сложившимися способами переработки нефти и газа. В США до 70 % общего объема этилена вырабатывают из газообразных углеводородов, преимущественно из этана, природного и попутного газов. В СНГ, странах Западной Европы и Японии, напротив, основную часть этилена получают пиролизом прямогонных бензинов и газойлей. При
пиролизе бензинов наряду с алкенами состава С2–С4 и бутадиеном образуется метано-водородная фракция, значительное количество жидких продуктов, содержащих алкены, циклоалкены, алкадиены, арены и другие компоненты. Выход продуктов при пиролизе бензинов различного состава колеблется
в широких пределах.
При пиролизе керосино-газойлевых фракций выход этилена составляет 16 – 23 %, пропилена – около 15 %, жидких продуктов – примерно 50 %.
Для интенсификации процессов пиролиза тяжелых нефтяных дистиллятов производят их предварительную гидрокаталитическую обработку: гидроочистку, гидродеароматизацию, гидрокрекинг (в присутствии водорода).
Коксование.Кокс образуется в жидкофазных термических процессах (при температуре 400…500 оС и давлении 0,3 МПа). Нефтяной кокс –твердое вещество плотностью 1400 – 1500 кг/м3 с высоким содержанием углерода. Атомное отношение С : Н в коксе составляет от 1,1 до 4.
Коксование осуществляется по схеме: арены ® смолы ® асфальтены ®
® кокс ® графит
Кокс применяют в качестве восстановителя в химической технологии, металлургии, авиационной и ракетной технике.
В условиях коксования асфальтены лишаются сольватной оболочки (она подергается крекингу), теряют алкильные заместители и функциональные группы (строение асфальтенов приведено в ч. 1, подраздел 2.6), расстояние между молекулами сокращается, ассоциаты становятся более компактными, увеличивается энергия их дисперсного притяжения, вследствие чего они последовательно (по мере потери водорода) переходят в карбены, карбоиды и кокс.
По данным рентгенографического анализа, кокс представляет собой агломерат хаотично расположенных трехмерно неупорядоченных кристаллитов, сходных по строению и размерам с ассоциатами асфальтенов, но с меньшим межслоевым расстоянием (0,348 – 0,350 нм). Начиная с 400 °С увеличивается толщина слоисто-блочных структур, что объясняется достройкой кристаллитов за счет вновь образующихся молекул асфальтенов.
Наличие в коксе водорода, а возможно, и метильных заместителей не дает возможности образоваться трехмерно упорядоченной структуре, подобной графиту. Такое упорядочение наступает при температуре выше 1200…1500 °С,
когда удаляется почти весь водород.
Коксование нефтяных остатков используется для получения электродного кокса (выход 10 – 40 % в зависимости от сырья и типа процесса). Кроме кокса
в данном процессе образуются газ (выход 10-20%) и дистилляты коксования (50 – 70%).
Рассмотрим механизм превращения углеводородов в условиях этих процессов.
1.1.1. Термические превращения углеводородов
Алканырасщепляются как по связям С–С, так и по связям С–Н. Так как энергия диссоциации связи С–С меньше энергии связей С–Н, наиболее вероятен распад С–С-связей. При их распаде из молекулы алкана в простом случае образуются алкен и алкан меньшей молекулярной массы:
CH3–CH2–CH2–CH2–CH3 ® СН3–СН=СН2 + СН3–СН3
либо
CH3–CH2–CH2–CH2–CH3 ® СН3–СН2–СН3 + СН2=СН2
При распаде по С-–Н -связям происходит дегидрирование алкана:
СН3–СН2–CH2–CH2–СН3 D СН3–CH2–CH2–СН=СН2 + Н2
 Для низших алканов (этан, пропан) преобладающей является реакция дегидрирования, для высших алканов – реакция распада по С–С-связям.
Для низших алканов (этан, пропан) преобладающей является реакция дегидрирования, для высших алканов – реакция распада по С–С-связям.
СН3–CH2–СН=СН2 + СН4
CH3–CH2–CH2–CH2–CH3 ® СН3–СН=СН2 + СН3–СН3
СН3–СН2–СН3 + СН2=СН2
CH3–CH2–CH2–CH=CH2 + Н2
Наиболее термически устойчив метан. Термическая деструкция метана термодинамически возможна при температурах выше 560 °С, однако со значительной скоростью он распадается только при 900 °С и выше. При температуpax более I 400°C метан распадается полностью на углерод и водород. Если время пребывания метана в зоне этой температуры мало, то, кроме углерода и водорода, можно получить этилен и ацетилен (до 10 %). На этом основано промышленное производство ацетилена из метана.
t
2СН4 ® НСºСН + 3Н2
Этан менее устойчив, чем метан. Заметная деструкция наступает при температуре более 500 °С. При 800 °С этан расщепляется со значительной скоростью, при этом основной является реакция дегидрирования
СН3–СН3 D СН2=СН2 + Н2
В меньшей степени происходит распад молекулы этана по углерод-углеродной связи. Пропан расщепляется легче, чем метан и этан. Заметная деструкция начинается выше 450 °С и проходит по двум направлениям:
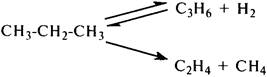
Бутан начинает заметно расщепляться при температурах выше 430 °С и подвергается тем же превращениям, что и пропан, т. е. дегидрированию и расщеплению по связи С-С.
Начиная с пентана, расщепление по углерод-углеродной связи становится преобладающим. Высшие алканы расщепляются только по таким связям, причем по мере увеличения числа атомов углерода в молекуле возрастает скорость крекинга. Относительная скорость крекинга углеводородов (u) с различной молекулярной массой представлена в таблице (по данным М. Д. Тиличеева [11]):
| Число атомов углерода в молекуле углеводорода | C5 | С6 | С7 | С8 | С10 | С12 | С20 |
| Скорость крекинга u |
Такое резкое увеличение скорости крекинга объясняется уменьшением энергии диссоциации углерод-углеродных связей с ростом числа атомов углерода в молекуле углеводорода.
Место разрыва связей в молекуле алкана определяется энергиями диссоциации связей, а также температурой и давлением. При умеренных температурах 400…500 °С разрыв происходит ближе к середине молекулы, т. е. по наименее прочным связям. Так, например, в молекуле октана энергия диссоциации углерод-углеродных связей (кДж/моль) имеет следующие значения:
С – С – С – С – С – С – С – С
335 322 314 310 314 322 335
С повышением температуры становится равновероятным разрыв любых связей в молекуле. Уменьшение давления способствует разрыву связей ближе
к концу молекулы, так как при этом образуются продукты с большей упругостью пара, что находится в соответствии с принципом Ле-Шателье. При повышении давления место расщепления смещается к центру молекулы, так как при этом образуются продукты с меньшей упругостью пара.
Изоалканы подвергаются крекингу несколько легче, чем алканы нормального строения, хотя некоторые изоалканы симметричного строения термически стабильны.
Термический крекинг углеводородов протекает по радикально-цепному механизму. Такой механизм крекинга алканов был впервые предложен американским химиком Райсом (1934). Большое значение в создании теоретических основ высокотемпературных реакций углеводородов имела разработанная академиком Н. Н. Семеновым общая теория цепных реакций (1958).
Молекулярные реакции в условиях термических газофазных некаталитических процессов играют незначительную роль, а ионные реакции практически отсутствуют, так как гетеролитический распад С–С-связи требует энергии »1200 кДж/моль, в то время как гомолитический – »360 кДж/моль (при гетеролитическом разрыве связи пара электронов остается у одного из атомов, при гомолитическом – у каждого из связанных прежде атомов остается по одному электрону). Большие затраты энергии при гетеролитическом процессе обусловлены необходимостью преодоления электростатического взаимодействия ионов и их нестабильностью в несольватированном состоянии.
В соответствии с радикально-цепным механизмом крекинг проходит через следующие стадии.
1. Зарождение цепи(образование свободных радикалов). При термическом распаде алканов, начиная с этана, в результате разрыва связи С–С происходит зарождение цепи с образованием свободных радикалов:
CH3–CH2–CH3 D CH3–CH2·+ CH3·
 В случае алканов с большим числом атомов углерода при не очень высоких температурах крекинга (350…450°С) разрыв углеводородной цепи происходит посередине, т. е. по наименее прочным связям С-С. При более высоких температурах могут разорваться и другие углерод-углеродные связи. При зарождении цепи значительно менее вероятен разрыв С-Н-связей углеводородов. Он возможен только в случае низших алканов (этан, пропан) при соударении их молекул со стенкой реактора при высоких температурах. Так как атомы водорода являются внешними атомами в молекулах, то при соударении со стенкой реактора может произойти отрыв атома водорода:
В случае алканов с большим числом атомов углерода при не очень высоких температурах крекинга (350…450°С) разрыв углеводородной цепи происходит посередине, т. е. по наименее прочным связям С-С. При более высоких температурах могут разорваться и другие углерод-углеродные связи. При зарождении цепи значительно менее вероятен разрыв С-Н-связей углеводородов. Он возможен только в случае низших алканов (этан, пропан) при соударении их молекул со стенкой реактора при высоких температурах. Так как атомы водорода являются внешними атомами в молекулах, то при соударении со стенкой реактора может произойти отрыв атома водорода:
CH3–CH2 –H D CH3–·CH2 + H·
Радикалы могут образовываться и по бимолекулярной реакции:
С3Н6 + С2Н4 D ·С2H5 + ·С3Н5;
С2Н6 + С2Н4 D 2 ·С2Н5
По сравнению с мономолекулярным роль бимолекулярного процесса возрастает с повышением давления и снижением температуры.
2. Продолжение цепи(реакции свободных радикалов). Радикалы представляют собой химически ненасыщенные частицы и обладают высокой реакционной способностью, так как содержат неспаренный электрон. Поэтому они стремятся стабилизироваться и подвергаются различным превращениям.
а) Распад радикалов. Радикалы распадаются по b-связям (С–С или менее вероятно С–Н), находящимся в b-положении по отношению к атому углерода, несущему неспаренный электрон. В результате распада образуются ненасыщенные молекулы и новые свободные радикалы с меньшей молекулярной массой. Если распад неразветвленного вторичного алкильного радикала может произойти по нескольким направлениям, то энергетически более выгоден процесс, при котором образуется радикал с наибольшей молекулярной массой.
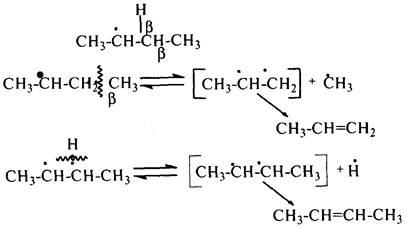
Относительно устойчивыми к распаду являются низшие алифатические радикалы: ·СН3, СН3С·Н2. Такие радикалы, как СН3-С·Н2, СН3-С·Н-СН3, ·С(СН3)3, могут распадаться только с разрывом b–С–Н-связей. Другие радикалы распадаются с разрывом как b–С–С-, так и b–С–Н-связей, причем разрыв b–С–С-связей протекает легче. Энергия диссоциации для различных b-связей С–С
в радикалах изменяется в пределах 42 – 84 кДж/моль.
б) Изомеризация радикалов. Первичные радикалы могут изомеризоваться
в более стабильные вторичные. Изомеризация протекает в результате внутримолекулярной миграции атома водорода из положения 4 или 5 в положение 1 через циклическое переходное состояние (1,4- и 1,5-изомеризация). Например, 1,5-изомеризация:
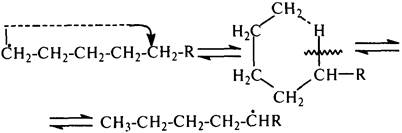
1,2- и 1,3-изомеризации мало вероятны вследствие низкой стабильности соответствующих переходных состояний.
Для аренов наблюдается 1,2-переход фенильного радикала:
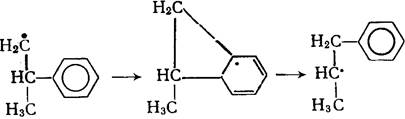
Изомеризация радикалов протекает значительно медленнее, чем их распад по b-связи.
в) Реакции радикалов с молекулами углеводородов (реакции передачи цепи). Это основные реакции, приводящие к развитию цепи. Низшие свободные радикалы (·Н, ·СН3, ·С2Н5) при столкновении с молекулами алканов отрывают от них атомы водорода:
R–H + H· D R· + Н2
R–H + ·CH3 D R· + CH4
Другие радикалы (состава С3, С4 и выше) также могут вступать в эти реакции при повышенных давлениях (2 – 5 МПа) и температурах до 600 °С. Однако в условиях пиролиза они значительно легче распадаются, чем вступают в эти реакции. При взаимодействии радикала с молекулой углеводорода, в частности алкана, возможен отрыв атомов водорода от первичных, вторичных и третичных атомов углерода. Вероятность отрыва первичного, вторичного и третичного атомов водорода зависит как от легкости разрыва связи С–Н, так и от количества соответствующих атомов водорода в молекуле углеводорода. Третичные атомы водорода отщепляются в 10 раз, а вторичные – в 2 раза быстрее, чем первичные.
Температура существенно влияет на соотношение скоростей отрыва различных атомов водорода. При небольших температурах (300…400 оС) относительная активность атомов водорода сильно различается. Например, по отношению к ·СН3 при 455 К относительные активности первичных, вторичных
и третичных атомов водорода соотносятся как 1 : 7 50. С повышением температуры различия в относительных активностях сглаживаются.
3. Обрыв цепи.Осуществляется следующими реакциями.
а) Рекомбинация радикалов происходит при их столкновении, когда концентрация радикалов в системе становится значительной:
·СН3 + ·СН3 D СН3–СН3
СН3–СН2–С·Н2 + ·СН3 D СН4 + СН3–СН=СН2
б) Диспропорционирование радикалов (процесс, обратный бимолекулярной реакции образования радикалов):
2С2Н5· D С2Н6 + С2Н4
Рассмотрим пример термического крекинга бутана при температуре 500…600 °С. В этих условиях бутан подвергается преимущественно расщеплению по связям С–С:
СН3–СН2–СН2–СН3 D СН4 + СН3–СН=СН2
СН3–СН2–СН2–СН3 D СН2=СН2 + СН3–СН3
Зарождение цепи проходит в результате разрыва связи С–С:
 СН3–СН2–СН2–СН3 ® 2СН3–СН2·
СН3–СН2–СН2–СН3 ® 2СН3–СН2·
 или
или
СН3–СН2–СН2–СН3 ® СН3· + ·СН2–СН2–СН3
Столкновение свободных радикалов с молекулами бутана приводит к развитию цепи. При этом возможен отрыв атомов водорода от первичного или вторичного атомов углерода с образованием радикалов бутила иливторичного бутила:
I направление
СН3–СН2–СН2–СН3 + ·СН3 ® СН4 + СН3–СН2СН2С·Н2
бутил
II направление
СН3–СН2–СН2–СН3 + ·СН3 ® СН4 + СН3–СН2–·СН–СН3
втор-бутил
Бутил распадается с образованием этилена и этана:
 СН3–СН2–СН2–С·Н2 ® СН2=СН2 + СН3–С·Н2
СН3–СН2–СН2–С·Н2 ® СН2=СН2 + СН3–С·Н2
этилен
СН3–С·Н2 + СН3–СН2–СН2–СН3 ® СН3–СН3 + СН3–СН2СН2С·Н2
этан
 Вторичный бутил распадается с образованием пропилена и метана:
Вторичный бутил распадается с образованием пропилена и метана:
СН3–·СН–СН2–СН3 ® СН3–СН=СН2 + ·СН3
СН3· + СН3–СН2–СН2–СН3 ® СН4 + СН3–СН2СН2С·Н2
Радикальный механизм термического расщепления углеводородов (распад радикалов по b-связи С–С) объясняет преобладание этилена в газообразных продуктах пиролиза:
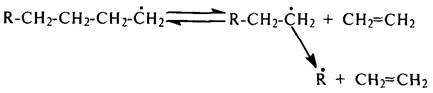
В небольшой степени протекает также изомеризация первичных радикалов во вторичные и последующий их распад с образованием пропилена:
R–CH2–CH2–CH2–C·H2 D R–CH2–CH2–·CH–CH3 D R–С·Н2 + СН2=СН–СН3
Нафтенытермически стабильнее алканов. Со значительной скоростью их распад протекает при температурах ~550 °С. Незамещенные нафтены (циклопентан, циклогексан) могут распадаться по следующим схемам:
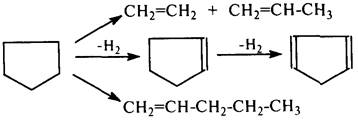
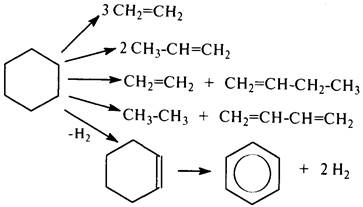
До температуры 700…750 °С механизм распада незамещенных нафтенов радикальный, но не цепной. Это объясняется быстрой стабилизацией образующихся бирадикалов при разрыве по С–С-связи.
Однако при накоплении в реакционной смеси олефинов, содержащих слабую b–С–С-связь по отношении к двойной связи, возможно протекание процесса и по радикально-цепному механизму. С увеличением температуры крекинга выше 750 °С вероятность радикально-цепного распада повышается:
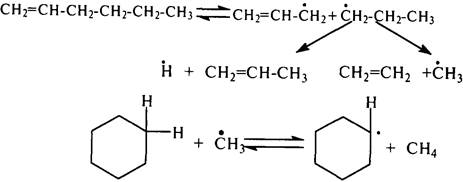
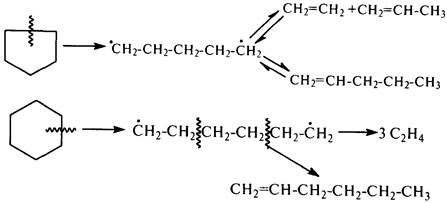
Алкилциклопентаны и алкилциклогексаны распадаются по радикально-цепному механизму. Зарождение цепи происходит при разрыве С–С-связи боковой цепи либо путем отрыва метильной группы от молекул метилпроизводных.
Бициклические нафтены подвергаются дециклизации и дегидрированию
с образованием смеси углеводородов ряда бензола, олефинов, нафталина.
Ароматические углеводородыобладают высокой термической стабильностью. Наибольшую термическую стабильность имеют незамещенные арены. Самой слабой в молекуле бензола является связь С–Н, энергия диссоциации которой равна 427 кДж/моль. Разрыв связи С–С требует 494 кДж/моль, поэтому в условиях пиролиза основной реакцией бензола является его дегидроконденсация с образованием дифенила:
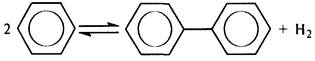
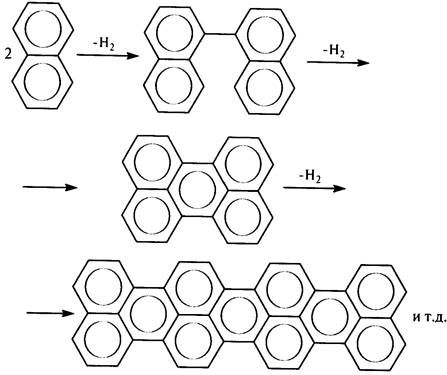
Реакция дегидроконденсации ароматических ядер вместе с реакцией диенового синтеза лежит в основе процесса образования кокса при крекинге
и пиролизе.
Кокс по своей структуре представляет собой поликонденсированную ароматическую систему, которая может образоваться в результате процесса дегидроконденсации ароматических ядер. Например:
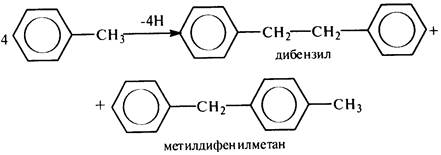
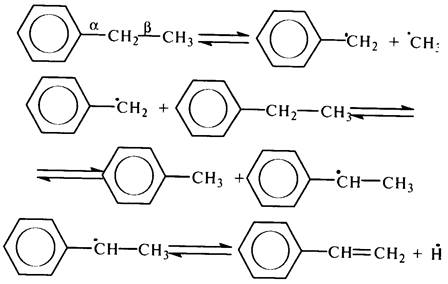
В молекуле толуола расщепляется наименее прочная связь С–Н бензильного атома углерода (энергия связи 326 кДж/моль), приэтом основными продуктами являются дибензил и метилдифенилметан:
Алкилбензолы распадаются по наименее прочной b–С–С-связи по отношению к бензольному ядру (энергия диссоциации связи 272 кДж/моль). Так, этилбензол при крекинге образует толуол и стирол:
Дата добавления: 2014-12-29; просмотров: 12456;
