Тяжелые металлы
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Виды металлов
1. Щелочны́е мета́ллы — элементы главной подгруппы I группы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
2. Щёлочноземельные металлы — химические элементы: кальций Ca, стронций Sr, барий Ba, радий Ra (иногда к щёлочноземельным металлам ошибочно относят также бериллий Be и магний Mg). Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают воде щёлочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов.
3. Перехо́дные мета́ллы (перехо́дные элеме́нты) — элементы побочных подгрупп, в атомах которых появляются электроны на d- и f-орбиталях.
4. Другие металлы. Свинец — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов, с атомным номером 82.
Олово — элемент главной подгруппы четвёртой группы, пятого периода периодической системы химических элементов, с атомным номером 50. Олово образует несколько аллотропных модификаций: ниже 13,2 °С устойчиво α-олово (серое олово) с кубической решёткой типа алмаза, выше 13,2 °С устойчиво β-олово (белое олово) с тетрагональной кристаллической решеткой.
Среди многих негативных последствий хозяйственной деятельности человека особое место занимает загрязнение окружающей среды тяжелыми металлами. Многие тяжелые металлы являются чрезвычайно токсичными даже в следовых количествах. Они способны концентрироваться в живых организмах, вызывая при этом различные патологии развития. В отличие от органических веществ, подвергающихся процессам разложения, металлы способны лишь перераспределяться между природными средами.
Роль тяжелых металлов двойственна: с одной стороны, они необходимы для нормального протекания физиологических процессов, являясь катализаторами многих реакций; с другой стороны, металлы токсичны при повышенных концентрациях. Наибольшую опасность для человека и живой природы представляют подвижные формы металлов, поскольку они характеризуются высокой биологической активностью.
Способность тяжелых металлов катализировать многие органические и неорганические реакции является одной из главных характеристик данного класса соединений. Многие тяжелые металлы легко соединяются с биомолекулами (например, с белками, пептидами, липидами, аминокислотами), образуя комплексные соединения. Именно через реакции комплексообразования с тяжелыми металлами протекают все основные процессы в живых организмах. По чувствительности живых организмов к тяжелым металлам их можно расположить в ряд:
Hg>Cu>Zn>Ni>Pb>Cd>Cr>Sn>Fe>Mn>Al. (54)
Тяжелые металлы проявляют широкое токсическое действие. Причем механизм воздействия индивидуален для каждого металла и обусловлен конкурирующими реакциями между необходимыми и токсичными металлами за места связывания в белковых молекулах. Основные биогеохимические свойства тяжелых металлов представлены в табл. 7.
Таблица 7 - Биогеохимические свойства тяжелых металлов
| Свойства | Co | Ni | Cu | Zn | Cd | Hg | Pb |
| Биохимическая активность | В | В | В | В | В | В | В |
| Токсичность | У | У | У | У | В | В | В |
| Канцерогенность | В | В | В | В | В | В | В |
| Обогащение глобальных аэрозолей | Н | Н | В | В | В | В | В |
| Минеральная форма распространения | В | Н | Н | Н | В | В | В |
| Органическая форма распространения | Н | Н | У | У | В | В | В |
| Подвижность | Н | Н | У | У | В | В | В |
| Тенденция к биоконцентрированию | В | В | У | У | В | В | В |
| Эффективность к накоплению | У | У | В | В | В | В | В |
| Комплексообразующая способность | Н | Н | В | В | У | У | Н |
| Склонность к гидролизу | Н | У | В | В | У | У | У |
| Растворимость | Н | Н | В | В | В | В | В |
| Время жизни | В | В | В | В | Н | Н | Н |
В – высокая, У – умеренная, Н – низкая.
Поступление тяжелых металлов в окружающую среду имеет как естественное, так и техногенное происхождение. Главными антропогенными источниками поступления тяжелых металлов в атмосферу являются предприятия цветной металлургии, нефтепереработки, химическая промышленность и автомобильный транспорт. В атмосферном воздухе тяжелые металлы присутствуют в форме органических и неорганических соединений в виде пыли и аэрозолей, а ртуть – в основном в элементарном состоянии. Находящиеся в воздухе металлы и их соединения вымываются атмосферными осадками или оседают естественным путем на поверхности почв и растений.
В водных средах тяжелые металлы могут присутствовать в виде коллоидных или взвешенных частиц, а также в растворенном состоянии в виде свободных ионов или комплексных соединений. В водные среды металлы попадают с атмосферными осадками, за счет вымывания из почв (естественные процессы), а также вместе со сточными водами предприятий и ливневой канализации. Формы миграции тяжелых металлов в природных подземных и поверхностных водах определяются геохимическим типом вод, а также их кислотно-щелочными характеристиками. В кислых и нейтральных водах металлы присутствуют в основном в виде акватированных ионов, в щелочных – в виде гидроксокомплексов, карбонатов, органических комплексов.
Уровни содержания тяжелых металлов в почвах зависят от окислительно-восстановительных и кислотно-основных свойств. Обычно с увеличением кислотности почвы подвижность тяжелых металлов возрастает. Металлы в почвах присутствуют в водорастворимой, ионообменной и адсорбированной формах. Водорастворимые формы представлены, как правило, нитратами, хлоридами, сульфатами и органическими комплексами.
Основной источник поступления тяжелых металлов в организм человека – пища, при этом наибольший вклад вносит потребление в пищу растений, выращиваемых на полях вблизи промышленных предприятий и автотрасс. Токсичность тяжелых металлов проявляется в значительной степени на кислых почвах и реже на нейтральных и щелочных.
Пути поступления тяжелых металлов в почву. Насчитывают не менее 6 типов антропогенно-технических воздействий, которые могут вызвать разного уровня ухудшение почв. В их числе:
1) водная и ветровая эрозия,
2) засоление, подщелачивание, подкисление,
3) заболачивание,
4) физическая деградация, включая уплотнение и коркообразование,
5) разрушение и отчуждение почвы при строительстве, добыче полезных ископаемых,
6) химическое загрязнение почв.
Сорбция тяжелых металлов почвами. В то же время количественные закономерности адсорбции и ионного обмена могут быть описаны сходными по форме уравнениями. Для описания изотерм адсорбции ТМ пользуются уравнением Фрейндлиха или уравнением Ленгмюра. Эмпирическое уравнение Фрейндлиха имеет вид
Lg x/m =lg Kф +1/n lg C C = 1 + C (55)
x/m Klb b
где х/m и С – концентрация ТМ в адсорбированном состоянии и в равновесном растворе соответственно. Кф и 1/n – константная и максимальная адсорбция ТМ в уравнении Ленгмюра.
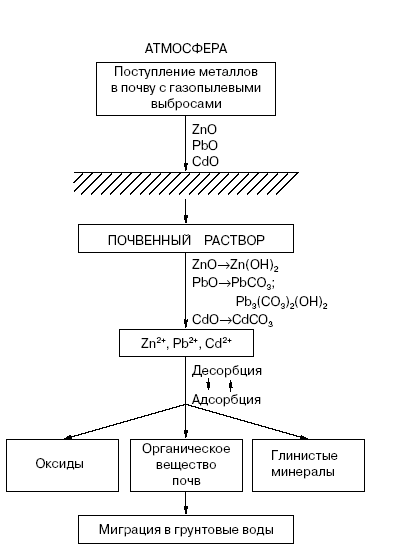
Рисунок 28 - Трансформация и миграция тяжелых металлов в почве
Реакции с простыми веществами. С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
- 4Li + O2 = 2Li2O оксид лития
- 2Na + O2 = Na2O2 пероксид натрия
- K + O2 = KO2 надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Na2O2 + 2Na = 2Na2O (56)
Со среднмими и малоактивными металлами реакция происходит при нагревании:
3Fe + 2O2 = Fe3O4 (57)
2Hg + O2 = 2HgO (58)
2Cu + O2 = 2CuO (59)
С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
6Li + N2 = 2Li3N (60)
При нагревании:
2AL + N2 = 2AlN (61)
3Ca + N2 = Ca3N2 (62)
С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
Fe + S = FeS (63)
С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
2Na + H2 = 2NaH (64)
Mg + H2 = MgH2 (65)
С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодествии с водой дают ацетилен, метаниды — метан.
2Na + 2C = Na2C2 (66)
Na2C2 + 2H2O = 2NaOH + C2H2 (67)
2Na + H2 = 2NaH (68)
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного расплава.
Сорбция ионов металлов на катионообменных центрах почвенных частиц. Принципы образования хелатных соединений. Хелатообразующие комплексы почв. Образование внутрикомплексных хелатов металлов. Подкисление почв. Восстановление серы анаэробными сульфатредуцирующими бактериями. Накопление серы, подщелачивание почв. Радионуклиды. Цезий, йод, стронций, радий и уран в почвах. Сорбция.
Характеристики почв: гранулометрический состав, объем пор, гигроскопичность, рН, ионообменная емкость. Песчаные и глинистые почвы. Классификация почв по гранулометрическому составу, диаметру пор, содержанию песка и глины.
Рисунок 29 - Вода в почвах
Дата добавления: 2014-12-27; просмотров: 4582;
