Получение
1. Нитрование парафинов по Коновалову (см. свойства предельных углеводородов)
2. Парофазное нитрование предельных углеводородов 67% HNO3 при 500-6000С.
3. Нитрование окисями азота
R + N2O4 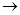 RNO2 + NO2
RNO2 + NO2
4. Действие солей азотистой кислоты на галогенопроизводные (реакция Мейера-Коренблюме), может протекать в двух направлениях

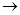 C2H5-NO2 + NaBr
C2H5-NO2 + NaBr
C2H5Br + NaNO2- Нитроэтан
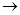 C2H5-O-N=O + NaBr
C2H5-O-N=O + NaBr
Этилнитрит
Механизм – нуклеофильное замещение. Реагент – нитрит-анион, образующийся при диссоциации нитрита в результате сопряжения. Может давать две граничные структуры (с 1 и 2)
Na-O-N=O 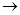 Na+ + -O-N=O
Na+ + -O-N=O  O=N-O-
O=N-O-
Нитританион
Такая равновесная структура обозначается следующим образом:
O-N-O
и называется резонансной структурой.
Отрицательный заряд распределен поровну между атомами кислорода, а азот имеет неподеленную пару электронов. Взаимодействие нитританиона с галоидным алкилом может идти как за счет атома кислорода, так и азота. Если реакция идет по механизму SN1, то нитританион присоединяется по месту наибольшей электронной плотности, т.е. по кислороду, и образуется эфир.
CH3 CH3 CH3
CH-I  I- + +CH
I- + +CH  CH-O-N=O
CH-O-N=O
CH3 CH3 O—N=O CH3
Изопропилнитрит
Этому механизму способствует:
1. Использование третичных и вторичных галоидных алкилов;
2. Применение протонных полярных растворителей (вода, спирт);
3. Использование AgNO2.
Если реакция идет по механизму SN2, то нитроанион присоединяется по месту наибольшей нуклеофильности (наибольшего сродства к углероду), т.е. по азоту, имеющему неподеленную пару электронов.
H CH3
 -
-  + O H CH3 O
+ O H CH3 O
Br  C + :N
C + :N 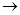 Br…C…N
Br…C…N 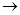 Br- + CH3-CH2-NO2
Br- + CH3-CH2-NO2
H O H O
Бромистый этил переходное состояние нитроэтан
Образуется нитросоединение.
Механизму SN2 способствует:
1. Использование первичных галоидных алкилов;
2. Апротонных растворителей;
3. Использование NaNO2.
Дата добавления: 2014-12-24; просмотров: 1283;
