Обратимые процессы — это физическая модель — это идеализация реальных процессов.
14 . Энтропия
Количество тепла δQ, которое должно быть доставлено системе или отнято у неё при переходе от одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но существенно зависит от способа осуществления этого перехода (δQ не является функцией состояния системы).
Однако, приведенное количество теплоты — отношение теплоты δQ к температуре Т системы при бесконечно малых изменениях состояния системы — есть функция состояния системы.
В любом обратимом круговом процессе
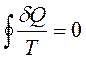
Следовательно, подынтегральное выражение есть полный дифференциал некоторой функции, которая определяется только начальным и конечным состояниями системы и не зависит от пути, каким система пришла в это состояние.
ЭнтропиейS называется функция состояния системы, дифференциалом которой является δQ/T:
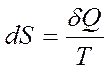 , соответственно
, соответственно 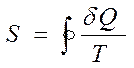 .
.
Т.о. первое начало термодинамики 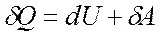 можно записать в виде
можно записать в виде
TdS = dU + δA, откуда
δA = TdS – dU = d(TS) – SdT – dU = - d(U – TS) – SdT =
- dF – S dT.
Функция F = U – TSявляется функцией состояния системы и называется энергией Гельмгольца или свободной энергией.
15. Изменение энтропии
В замкнутой системе - для обратимых процессов ΔS = 0 ;
- для необратимых циклов ΔS > 0.
Дата добавления: 2014-12-20; просмотров: 1138;
