Химические свойства
В алканах все атомы углерода связаны с четырьмя другими атомами, они находятся в состоянии sp3 – гибридизации в составе тетраэдра, соединены между собой и атомами водорода δ - связью. Ковалентная связь неполярная, расстояние между атомами – 0,154 нм, энергия связи – 339 кДж/моль. У атомов С и Н полностью заполнены электронные оболочки, нет неподеленных пар
Таблица 3. Физические свойства алканов и циклоалканов.
| Название | Формула | Т пл., 0С | Т.кип. ,0С | ρ, г· см-3 |
| Метан Этан Пропан Бутан Изобутан Пентан 2-Метилбутан Неопентан Гексан 2-Метилпентан Гептан 2-Метилгексан 3-Метилгексан 2,2-диметилпентан Октан Нонан Декан Ундекан Додекан Тридекан Тетрадекан Пентадекан Гексадекан Гептадекан Октадекан Нонадекан Эйкозан Циклопропан Циклобутан Циклопентан Циклогексан |
СН4
СН3СН3
СН3СН2СН3
СH3CH2CH2CH3
CH3CH(CH3)CH3
CH3CH2CH2CH2CH3
(CH3)2CHCH2CH3
(CH3)4C
CH3(CH2)4CH3
(CH3)2CHCH2CH2CH3
CH3(CH2)5CH3
(CH3)2CH(CH2)3CH3
CH3CH2CH(СН3)CH2CH3
(CH3)3CCH2CH2CH3
CH3(CH2)6CH3
CH3(CH2)7CH3
CH3(CH2)8CH3
CH3(CH2)9CH3
CH3(CH2)10CH3
CH3(CH2)11CH3
CH3(CH2)12CH3
CH3(CH2)13CH3
CH3(CH2)14CH3
CH3(CH2)15CH3
CH3(CH2)16CH3
CH3(CH2)17CH3
CH3(CH2)18CH3


| - 182,5 - 183,2 - 189,9 - 138,3 - 159,4 - 129,7 - 159,9 - 19,8 - 94,3 - 153,7 - 90,5 - 119 - 119,5 - 125 -56,5 -54 - 29,7 - 26,5 - 12 -6 + 5,5 + 10 + 18,2 + 22,5 + 28 + 32 + 36,5 - 127 - 90 - 94 +6,6 | - 161,4 - 88, 6 -42,2 - 0,5 - 11,7 + 36,0 + 27,8 + 9,4 + 68,7 + 60,3 + 98,5 + 90 + 92 + 79.2 + 126 + 151 + 174 + 196 + 214,5 + 234 + 252,5 + 270 + 287,5 + 303 + 317 + 330 + 205 (15 мм рт.ст.) - 33 +11 +49 +81 | 0,415 (-1640С) 0,546 (-880С) 0,585 (-440С) 0,600 0,603 (190С) 0,631 (260С) 0,62 (200С) 0,591 0,659 0,654 0,684 0.680 0,687 0,674 0.704 0,718 0,730 0,741 0.766 (00С) 0,757 0,762 0,769 0,773 0,778 0,777 (280С) 0,777 (320С) 0,778 (370С) 0,720 (-790С) 0,700 0,745 0,778 |
.
электронов, поэтому они химически нейтральны. Угол между соседними σ-связями С–С 109028/. В обычных условиях на алканы не действуют концентрированные кислоты и щелочи, они инертны по отношению к сильным окислителям, восстановителям, не взаимодействуют с электрофилами и нуклеофилами. Для соединений этого класса характерны реакции замещения, протекающие по радикальному характеру гомолитического типа, дегидрирования и окисления.
1. Характерным примером реакции радикального замещения SRявляется хлорирование метана. Реакция протекает при нагревании или облучении смеси ультрафиолетовым светом. При этом атом хлора замещает атом водорода в метане, а второй атом хлора связывает атом водорода.
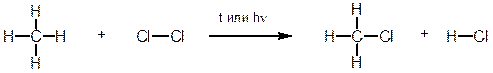

Образующийся в ходе реакции хлорметан в свою очередь вступает в реакцию с хлором с образованием дихлорметана (хлористого метилена). Далее реакция может продолжаться с образованием CHCl3 (хлороформа) и далее – четыреххлористого углерода (CCl4).
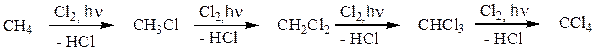
В реакции может образоваться четыре продукта. Для проведения реакции монохлорирования используют большой избыток метана. Основным продуктом реакции будет хлористый метил. Большое различие в температурах кипения между метаном и хлорметаном (> 130о С) позволяет легко отделить непрореагировавший метан и использовать его повторно. Аналогично проводят реакцию получения тетрахлорметана, используя большой избыток молекулярного хлора. В этом процессе разделение продукта и непрореагировавшего реагента еще проще, потому что при комнатной температуре хлор находится в газообразном состоянии, а четыреххлористый углерод – жидкость. Аналогичная схема соответствует бромированию метана.
Реакция метана с йодом не протекает, а с фтором протекает с взрывом даже в темноте и при комнатной температуре.Таким образом, реакционная способность галогенов в реакции с метаном изменяется в порядке: F2 > Cl2 > Br2 > I2.
Механизм свободнорадикального замещения метана хлором можно предста-
вить следующей схемой:
инициирование: Сl – Cl  2 Cl·
2 Cl·
рост цепи: CH4· + Cl·  CH3· + HCl CH3· + Cl2
CH3· + HCl CH3· + Cl2  CH3Cl + Cl·
CH3Cl + Cl·
CH3Cl + Cl·  СlCH2· + HCl СlCH2· + Cl2
СlCH2· + HCl СlCH2· + Cl2  CH2Cl2 + Cl·
CH2Cl2 + Cl·
CH2Cl2 + Cl·  ·CHCl2 + HCl ·CHCl2 + Cl2
·CHCl2 + HCl ·CHCl2 + Cl2  CHCl3 + Cl·
CHCl3 + Cl·
CHCl3 + Cl·  ·CCl3 + HCl ·CCl3 + Cl2
·CCl3 + HCl ·CCl3 + Cl2  CCl4 + Cl·
CCl4 + Cl·
обрыв цепи, например: ·CHCl2 + Cl·  CHCl3 или ·CCl3 + Cl·
CHCl3 или ·CCl3 + Cl·  CCl4
CCl4
На первой стадии реакции (инициирование) под действием ультрафиолетового облучения или нагрева происходит гомолитический разрыв связи в молекуле хлора с образованием атомарного хлора. При столкновении атома хлора с молекулой метана отрывается атома водорода и образуется метильный радикал. Метильный радикал отрывает от молекулы хлора атом со связывающим электроном, образуя хлористый метил с образованием свободного атома хлора.
Реакция является цепной, так как на каждой стадии образуется частица, вызывающая следующую стадию. Стадии роста цепи не могут продолжаться бесконечно. Стадии, в которых радикальные частицы не генерируются, называются стадиями обрыва цепи (рекомбинация свободных радикалов)
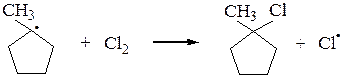
Галогенирование высших алканов протекает по тому же механизму, что и галогенирование метана. Начиная с пропана, возможно образование изомерных галогенопроизводных. При этом соотношение продуктов определяется устойчивостью свободных радикалов, которая уменьшается в ряду: третичный > вторичный > первичный > метильный,а также экранизацией радикала другими группами. У третичного радикала наибольшая степень делокализации неспаренного электрона, поэтому он более устойчив, чем вторичный, вторичный радикал более устойчив, чем первичный, а первичный устойчивее радикала метил.
Так, в реакции бромирования метилбутана возможно образование четырех монобромпроизводных I-IV. Соединения I и IV являются первичными бромопроизводными, II – третичными, а III – вторичными. В результате бромирования получается более 95 % соединения II, около 5 % соединения III и следы соединений I и IV.
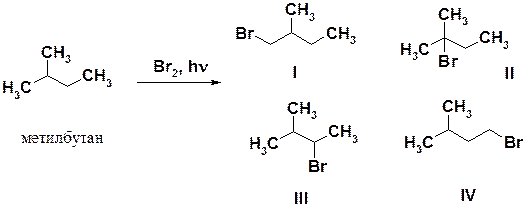
Общая закономерность реакций заключается в том, что, чем устойчивее частица, тем легче она образуется. Этот вывод относится к свободным радикалам, катионам и анионам. Причина изменения стабильности свободных радикалов заключается в делокализации неспаренного электрона, находящегося на p-орбитали и состоящего в сопряжении с электронами s-связей. Чем больше разветвлена углеродная цепь у атома, несущего неспаренный электрон, тем выше стабильность радикала и, следовательно, тем легче и быстрее он образуется.
Относительные скорости бромирования по третичному, вторичному и первичному атомам углерода относятся как 1600:82:1. Хлор более реакционноспособный, следовательно, менее избирательный (селективный) реагент, поэтому разница в скоростях не столь значительна, составляет всего 5,0:3,8:1,0, соответственно, для получения моногалогенопроизводного алкана, следует проводить реакцию бромирования.
Аналогично галогенируются циклоалканы (исключение – циклопропан):
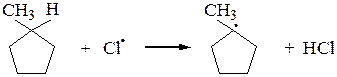
или
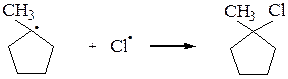
2. В 1888 г. М.И.Коновалов описал реакцию жидкофазного нитрования алканов при 100-150оС под действием 10-15 % азотной кислоты. Третичные атомы углерода также легче нитруются, чем вторичные, а вторичные легче, чем первичные. Реакция носит радикальный характер SR:
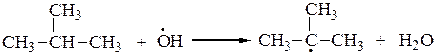
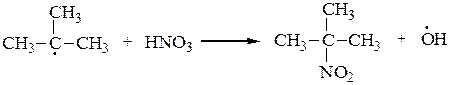
или
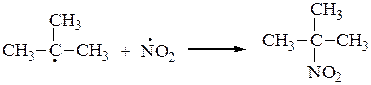
основной продукт
Молекула диоксида азота, образующаяся в процессе нитрования алканов, имеет неспаренный электрон, придающий ей свойства свободного радикала. Этот электрон делокализован на двух атомах кислорода и атоме азота:
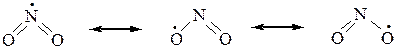
Это означает, что реакционным центром в NO2 является либо атом азота, либо один из атомов кислорода, а сама молекула обладает двойственной реакционной способностью. Поэтому молекула NO2, реагируя со свободными углеводородными радикалами за счет одного из центров, образует смесь изомерных веществ: нитросоединения и эфира азотистой кислоты R–O–N=O. Поскольку нитрование идет в жестких условиях, то оно сопровождается крекингом углеродной цепи, что дает также нитросоединения с более короткими радикалами.
3. Среди функционализированных алканов важное место занимают сульфопроизводные. Для введения в молекулу предельного углеводорода сульфогруппы обычно используют реакцию сульфохлорирования (действие SO2+Cl2) или сульфоокисления(SO2+O2). При освещении УФ-светом при 200С алканы с длиной углеродной цепи от 12 до 18 вступают в реакцию замещения со смесью хлора и оксида серы (IV) с образованием сульфохлоридов:
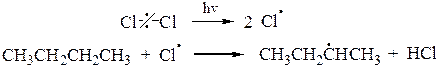
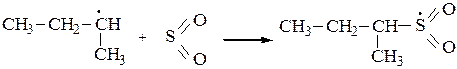
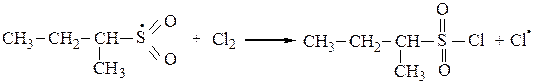
или 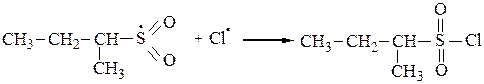
У вторичного атома углерода алкана атомы водорода легче замещаются, чем у первичного, в то время как у третичного атома не замещаются из-за пространственного затруднения.
При омылении щелочью образуются соли сульфокислот, применяющиеся как ПАВ при производстве синтетических моющих средств:
R - CН2 – SO2Cl + NaOH  R- CH2 – SO3Na + NaCl
R- CH2 – SO3Na + NaCl
Сульфоокислениепротекает по тем же механизмам, что и сульфохлорирование и представляет собой радикально-цепной процесс:
R–Н + SO2 + O2 + H2O  R – SO3Н + Н2О
R – SO3Н + Н2О
алкансульфокислота
Для алканов характерна инертность по отношению к обычным окислителям (КMnО4, КСr2О7 и т.д.) при комнатной температуре. Однако окисление алканов в присутствии кислорода воздуха приводит к их полному сгоранию до углекислого газа и воды с выделением большого количества тепла.

Эта реакция используется для получения тепла при горении природного газа СН4 и пропана, в тепловых электростанциях, при горении бензиновых фракций в двигателях автомобилей.
Дата добавления: 2017-09-19; просмотров: 1366;
