ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. АЛКАНЫ И ЦИКЛОАЛКАНЫ
РОССИЙСКАЯ МЕЖДУНАРОДНАЯ АКАДЕМИЯ ТУРИЗМА
С.А. Янковский
ОСНОВНЫЕ КЛАССЫ
ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Строение, синтез, физические и химические свойства
Москва 2015
УДК
ББК
Автор
С.А. Янковский
Рецензенты
Е.Н. Олсуфьева, доктор химических наук, профессор, главный
Научный сотрудник ФГБНУ «Научно-исследовательского
института по изысканию новых антибиотиков им. Г.Ф. Гаузе»
Е.В. Алексеенко, доктор технических наук, профессор кафедры химии
Московского государственного университета пищевых
Производств.
Основные классы органических соединений для
студентов направления подготовки 19.03.04 / С.А. Янковский;
Российская международная академия туризма. - М.: Логос,
С.
ISBN
Cоставлено в соответстии с требованиями Федерального
Государственного стандарта высшего профессионального
Образования по направлению подготовки 260800 «Технология
Продукции и организация общественного питания».
Описаны строение, методы синтеза, физические и химические
Свойства представителей основных классов органических
Соединений; рассмотрены способы идентификации и пути их
Взаимных превращений друг в друга.
Для студентов, аспирантов, преподавателей. Может быть
Использована для широким кругом читателей, чья деятельность
Связана с формированием профессиональных знаний и
Представлений в области пищевой отрасли.
УДК
ББК
ISBN С Российская международная академия
Туризма,2015
С Оформление. РМАТ, Логос, 2015
ПРЕДИСЛОВИЕ
Органическая химия занимает важное место в объяснении законов природы и создании материально-технической базы государства. Лекционный курс по органической химии является одним из самых трудоемких и сложных для восприятия студентами по сравнению с другими дисциплинами химического цикла. Это связано с большим разнообразием и сложным составом органических молекул, способностью веществ вступать в химические реакции различных типов, в постоянном использовании специфических понятий и терминологии. Пособие предназначено помочь студентам в усвоении лекционного и практического материала дисциплины в условиях сокращения аудиторной нагрузки. Чтобы преодолеть эти сложности, было необходимо разбить весь огромный массив органических соединений на отдельные классы, а все химические превращения – на группы – по типам реакций. С таких позиций много проще понять взаимосвязь строения веществ с обилием их химических превращений. Данное пособие построено по этому принципу. Оно содержит 18 глав, по количеству основных классов органических соединений, изучение которых предусмотрено рабочей программой Высшей школы. Каждый класс органических соединений также описан в строгой последовательности: строение реакционного центра и его особенности, специфика номенклатуры, пути синтеза, закономерности физических свойств и химические реакции соединений в строгой их классификации по типам. Для всестороннего объяснения наиболее важных химических процессов подробно рассматривается ряд теоретических вопросов, связанных с кинетикой, стереохимией и механизмами протекания реакций, а также явления изомерии и таутомерии. Указываются основные функциональные производные соединений каждого рассматриваемого класса. В ряде случаев особое внимание уделяется промышленно важным представителям класса. Материал изложен в простой и краткой форме. Автору против собственной воли пришлось проявить определенную сдержанность и не загружать пособие многочисленными примерами реакций, чтобы не увеличивать объем фактического материала, ибо учебник должен давать только основы науки. Для более глубоко изучения и более всестороннего изучения химии органических соединений различных классов студенты могут пользоваться дополнительными пособиями, монографиями и справочными изданиями; многие из них рекомендованы в списке литературы, расположенном в конце книги. Однотипная схема характеристик органических веществ и таблицы обобщающего характера должны помочь студентам лучше понять и проще запомнить закономерности изменений свойств и химические реакции соединений различных классов.
Последние разделы пособия особенно важны будущему пищевику. В них внимание уделено описанию свойств природных, биологически-активных и других органических веществ, которые являются либо распространенными компонентами пищевых продуктов (жиры, углеводы, аминокислоты, белки), либо широко используются в качестве пищевых добавок (консерванты, антиоксиданты, загустители, усилители вкуса и др.). Хотелось подвести читателя к мысли о том, что свойства даже самых сложных биологических и природных объектов, в значительной степени определяется свойствами простых органических функций, указать на тесную связь простых реакций со закономерностями сложных процессов, происходящих в живых системах и в процессе приготовления пищи. Какой бы сложной структурой не обладало бы природное соединение, можно в каждом случае вычленить ту элементарную органическую реакцию, которая будет ответственна за данные превращения.
В пособии имеются данные по идентификации веществ, необходимые при анализе и определении соответствия показателей качества и состава продукции на основе органических веществ и нормативных документов.
Материал пособия построен так, что позволяет читателю выборочно прорабатывать отдельные разделы, легко устанавливая связь как с предыдущим, так и с последующим материалом с помощью перекрестных ссылок. Для самостоятельной оценки качества полученных знаний в конце глав приводятся контрольные вопросы. Терминология и номенклатура органических соединений приводятся в соответствии с требованиями, принятыми в отечественной и международной химической литературе.
Пособие адресовано студентам, которые в дальнейшем будут специализироваться в тех областях исследования, где прочное знание органической химии необходимо для изучения различных биохимических и биотехнологических процессов и готовит фундамент, необходимый для освоения курсов биохимии, пищевой химии, химии пищевых добавок и др.
Учебное пособие предназначено для студентов нехимических вузов, в которых органическая химия изучается как отдельный предмет, а также может представлять интерес для преподавателей и учащихся школ и колледжей с углубленным изучением химии.
Автор выражает глубокую признательность проф. Смирновой И.Р., проф. Мазуру А.В., проф. Олсуфьевой Е.Н., проф. Алексеенко Е.В. за ценные советы и помощь в работе. Все замечания будут приняты с благодарностью.
УГЛЕВОДОРОДЫ
В зависимости от состава молекул все органические соединения делятся на классы. Соединения, молекулы которых состоят только из атомов углерода и водорода, относятся к классу углеводородов. Внутри класса соединения обычно классифицируются (подразделяются) на более мелкие группы по ряду других признаков. В частности, углеводороды, в зависимости от строения, подразделяются на соединения с открытой углеродной цепью (алифатические) и циклические. Те и другие, в зависимости от соотношения в них атомов углерода и водорода, подразделяются на предельные (насыщенные) и непредельные (ненасыщенные, а также ароматические).
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. АЛКАНЫ И ЦИКЛОАЛКАНЫ
Определение. Алифатические углеводороды, в молекуле которых атомы углерода связаны между собой и с атомами водорода одинарной связью (s-связь). Термин «насыщенный» означает, что каждый углерод в молекуле вещества связан с максимально возможным числом (четыре) атомов. Простейшим представителем алканов является метан СН4. В молекуле алканов атом углерода находится в sр3-гибридизации. Общая формула соединений этого ряда СnН2n+2 Каждый последующий представитель ряда отличается от предыдущего на гомологическую разность -CH2- (метиленовая группа). Такой ряд органических соединений с однотипной структурой, близкими химичес-кими и закономерно изменяющимися физическими свойствами называется гомологическим, а члены этого ряда – гомологами. Углеводороды с неразветв-ленной углеродной цепью называют углеводородами «нормального» строения.
Таблица 1.Число изомеров алканов
| Формула | Название | Число изомеров |
| СH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 C11H24 C12H26 C13H28 C14H30 C15H32 C20H42 C25H52 C30H62 C40H82 | Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан Ундекан Додекан Тридекан Тетрадекан Пентадекан Эйкозан Пентакозан Триаконтан Тетраконтан | 1 858 4 347 366 319 36 797 588 4 111 846 763 62 491 178 805 831 |
Начиная с четвертого члена этого ряда проявляется единственно возможный среди алканов вид структурной изомерии - изомерия углеродного скелета, причем это приводит к лавинообразному увеличению количества возможных изомеров с ростом числа углеродных атомов в молекуле (см. Табл. 1).
Источники и способы получения.Основным природным источником получения алканов является нефть, а для низших членов гомологического ряда – природный газ. В процессах фракционирования и при последующей терми-
Таблица 2. Перегонка и крекинг нефти и нефтепродуктов
При прямой перегонке нефти выделяют следующие фракции:
- газовая фракция (т. кип. до 400С)содержитС1-С5 алканы и изоалканы;
- бензин (т. кип. 40-1800С) содержит углеводороды С6-С10;
- керосин (т. кип. 180-2300С)содержит углеводороды С10-С12;
- соляровое масло (т. кип. 230-3050С)содержит углеводороды С13-С17;
- мазут (т. кип. выше 3050С) остаток после прямой перегонки при атмосферном или пониженном давлении;
- cмазочные масла (т. кип. 305-5150С)содержит углеводороды С18-С38, получают вакуумной перегонкой мазута;
- гудрон – остаток после вакуумной перегонки мазута
| Тип крекинга | Темпера-тура, 00С | Давл., МПа | Объект переработки | Катали-затор | Продукты крекинга | Приме-чание |
| Термический Высокотемпе-ратурный низкого давления Высокотемпе-ратурный при атм. давлении Каталитичес- кий Гидро- риформинг (в прис. Н2) Платформинг | 480-550 550-650 650-750 400-500 350-450 350-450 | 7-35 7-35 2-3 30- | Мазут, соляровое масло Соляровое масло Мазут, гудрон. Соляровое масло Мазут, бензин низ-косортный, соляровое масло. Бензин низ-косортный | ─ ─ ─ AlCl3 , алюмо- силикаты Оксиды и сульфи-ды Мo, Ni на алюмосиликатах. Pt,Pd (<1%) на Al2O3 , алюмо-силикат | Бензин Кокс, легкие углеводороды Алкены, арены Бензин (40%), газы (20%), кокс (6%) Бензин (до 70% на нефть). Бензин с октановым число >90. | Много алкенов. Октанов. число- 60 Сырье в в органич. синтезе Изоалканы Октанов. число- 85 Повышение качества бензина, изоалканы Изомеризация, дегид-роцикли- зация, аро-матизация |
ческой или термокаталитической переработке нефти получают смеси углеводородов различного состава и строения (см. Табл. 2).
Одним из промышленных источников получения смеси алканов (преимущественно неразветвленного строения) является синтез Фишера-Тропша. При пропускании водяного газа над кобальтом под давлением 15 атм и при 160-2000С можно получать смеси алканов различного состава от С5 до С17
Co; Ni; P ; 2000C
n CO + 2(2n+1) H2  CnH2n+2 + n H2O
CnH2n+2 + n H2O
Чтобы получать алканы определенного строения, необходимо прибегать к синтетическим методам. Разработаны пути синтеза алканов, позволяющие сохранять, уменьшать или увеличивать углеродную цепь исходного соединения.
1. Так, гидрирование непредельных углеводородов или полное восстановление многих классов органических соединений, например, галогеналканов приводит к сохранению формы и длины углеродной цепи:
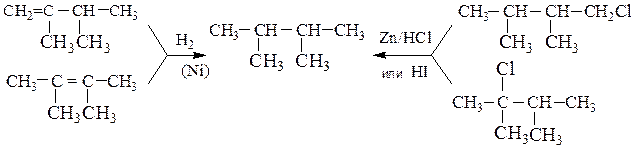
2-Метилбутен-1, 2-метилбутен-2 и 3-метилбутен-1, имеющие углеродный скелет 2-метилбутана, гидрируются до последнего. Метилциклопентан можно получить гидрированием 1-, 3- или 4-метилциклопентенов, а также метиленциклопентана.
2. Взаимодействие галогенопроизводных с натрием (реакция Вюрца) позволяет удлинять углеродную цепь, и в качестве единственного продукта реакции получают углеводород R-R симметричного строения:
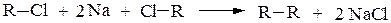
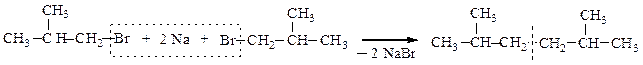
Если в реакцию Вюрца взять два различных галогеналкана, то образуется смесь из трех углеводородов, один из которых симметричным не будет:
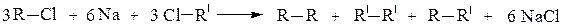
3. Если соль карбоновой кислоты алифатического ряда подвергнуть электролизу (анодный синтез Кольбе), то на аноде карбоксилат-анион отдает электроду один электрон, превращаясь в нестабильный радикал. Выброс СО2 приводит к алкильному радикалу. При рекомбинации двух алкильных радикалов образуется симметричный алкан с четным числом атомов углерода.
Электролиз: RCOONa → 2 RCОO─ + 2Na+
Анод: RCOONa → 2 RCОO─ - 2е →2 RCОO˙ → 2 R˙ + СО2 R˙ + R˙ → R–R
Катод: 2Na+ + 2Н2О + 2е → 2NaOH + H2 ↑
4. Реакции, приводящие к сокращению углеродной цепи:
а) пиролиз солей карбоновых кислот со щелочами:
R–COONa + NaOH  R–H + Na2CO3
R–H + Na2CO3
б) крекинг нефти: выше 5000С происходит разрыв связей С-С, причем получается смесь алканов и алкенов-1 в соотношении 1:1. Связи С-С в исходной молекуле практически равноценны, поэтому разрыв может произойти в любом месте. Катализ позволяет снизить температуру процесса и ведет к получению, наряду с нормальными углеводородами, разветвленных, что важно для получения бензинов с высоким октановым числом.
Конформационный анализ. Атомы углерода, связанные одинарной s-связью, свободно вращаются относительно друг друга. Для молекулы этана (СН3-СН3) возможно бесконечное число различных расположений атомов водорода в пространстве. Незакрепленные, постоянно меняющиеся расположе-ния атомов в пространстве называются конформациями и ихизображают проекциями Ньюмена. Для этого изобразим С1 в виде точки, С2 –круга. Посмотрим на молекулу этанавдоль связи С1→С2. Конформации отличаются потенциальной энергией (Е), т.к. атомы Н и связи С-Н отталкиваются тем сильнее, чем ближе они находятся друг к другу. Из бесконечного числа конформаций выделяют: заслоненную конформацию (а), обладающую максимальной энергией, когда атомы Н при различных атомах С наиболее приближены друг к другу, и заторможенную конформацию (б) с минимальной энергией, в которой эти атомы максимально удалены друг от друга.
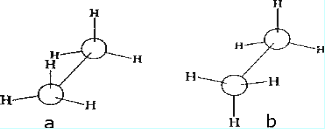
Рис. 1. Заслоненная (а) и заторможенная (б) конформации этана.
Разница в ~12 кДж/моль велика для утверждения того, что в данный момент времени абсолютное большинство молекул этана находятся в заторможенной конформации; эта величина и слишком мала, чтобы препятствовать вращению одной метильной группы относительно другой. Формы неустойчивые в отличие от конфигурационных форм транс- и цис- изомеров и не могут быть выделены.
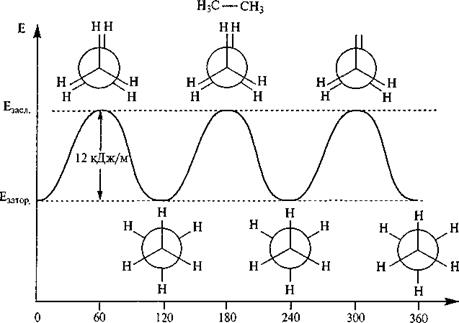
двугранный угол, град.
Рис. 2. Конформации этана и их относительная энергия
Молекула бутана имеет больше конформаций, чем этан. Наибольшую разность энергий имеют конформации, возникающие при вращении относительно друг друга атомов С2 и С3. СН3- группы сильнее отталкиваются друг от друга, чем атомы водорода, поэтому разность энергий между заслоненной и заторможенной конформациями больше, чем у этана (20 кДж/моль). Выделяют дополнительно скошенную конформацию,когда СН3- группы удалены друг от друга, но находятся ближе, чем в заторможенной конформации.
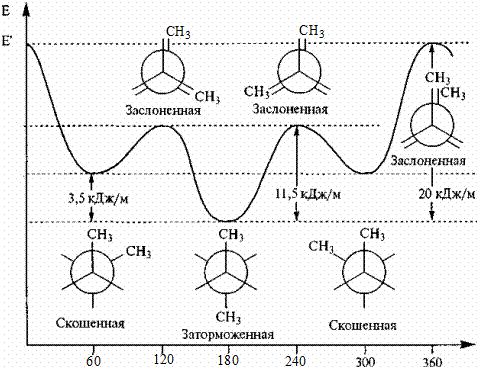
двугранный угол, град.
Рис. 3. Конформации бутана и их относительная энергия
Номенклатура. По рациональной номенклатуре алканы с разветвленной углеродной цепью рассматриваются как производные метана, образованные замещением атомов водорода в его молекуле на соответствующие радикалы. Радикалы – это остатки, условно образующиеся отщеплением от алкана одного атома водорода, вместо окончания –ан имеют окончание –ил. Например, CH3- называют метил, C2H5- этил и т.д. Весь массив таких остатков называют алкильными группами.
Для того чтобы назвать по рациональной номенклатуре приведенный ниже углеводород тетрадекан С14Н30: мысленно выбираем «центральный» атом углерода так, чтобы можно было назвать связанные с ним радикалы. При построении названия алкана радикалы располагают по старшинству (по мере увеличения количества атомов углерода и степени разветвленности), указывая количество одинаковых (ди-, три- или тетра-). Название завершается наименованием основного соединения – метана.
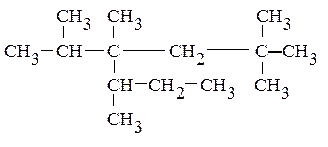
Приведенный выше алкан С14Н30 называется метилизопропилвторбутил-неопентилметаном. Рациональная номенклатура используется обычно для наименования только простых соединений.
В основе названия по номенклатуре IUPAC лежит название входящего в его конструкцию нормального алкана с наиболее длинной и самой разветвленной углеродной цепью. Положение заместителей называют приставками с указанием цифр, соответствующих номерам углеродных атомов главной цепи, при которых они находятся. Главную цепь нумеруют с того конца, чтобы заместители получили минимальные номера. Если есть несколько одинаковых заместителей, то для каждого из них через запятую записывается цифра (местоположение), а их количество указывается приставками ди-, три-, тетра-, пента- и т.д. Наименование алкана заканчивают названием нормального углеводорода, соответствующего длине главной цепи. В нашем примере алкан С14Н30 будет называться по IUPAC: 2,2,4,5-тетраметил-4-изопропилгептан.
Физические свойства предельных углеводородов представлены в Таблице 3.
Дата добавления: 2017-09-19; просмотров: 1609;
