Уравнение состояния реальных газов.
Свойства реальных газов закономерно отклоняются от свойств идеальных газов. Вследствие этого требовалась разработка нового уравнения состояния, которое связывало бы между собой значения p, V и T и давало бы возможность, пользуясь ограниченным числом экспериментальных данных, рассчитать некоторые свойства газов для разных условий, не прибегая к дорогостоящим и не всегда доступным прямым измерениям.
Для дальнейшего разбора вопроса мы обратимся к одному из наиболее ранних и наиболее изученных уравнений состояния реальных газов – уравнению Ван-дер-Ваальса.
Это уравнение получается из уравнения состояния идеальных газов в результате введения в него поправок на наличие у молекул собственного объема и на взаимное их притяжение.
уравнение Ван-дер-Ваальса, отнесенное к одному молю вещества, представляют обычно в виде:
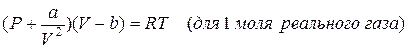
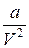 – поправка, учитывающая взаимное притяжение молекул, которое действует как некоторое давление
– поправка, учитывающая взаимное притяжение молекул, которое действует как некоторое давление 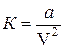 , сжимающее газ. Его называют внутренним давлением и считают, что оно обратно пропорционально квадрату объема.
, сжимающее газ. Его называют внутренним давлением и считают, что оно обратно пропорционально квадрату объема.
а – способность молекул к взаимному притяжению.
в – поправка, учитывающая собственный объем молекул и взаимное отталкивание между ними при малых расстояниях.
Кроме уравнения Ван-дер-Ваальса используют ряд других уравнений состояния реальных газов:
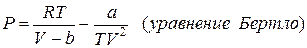
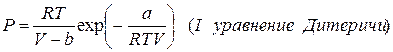
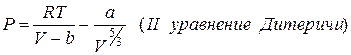
Все уравнения записаны для 1 моля газа, a и b – индивидуальные постоянные газов.
С высокой точностью поведение любого реального газа можно описать с помощью вириального разложенияпо степеням обратного объема:
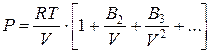
или давления:
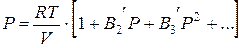
где В2, В3 и т.д. (В2΄, В3΄ и т.д.) – вириальные коэффициенты, которые зависят от температуры.
В2 – второй вириальный коэффициент; В3 – третий вириальный коэффициент.
Уравнение состояния идеального газа и вириальное уравнение состояния реального газа можно вывести методами статистической термодинамики.
Иногда уравнения состояния реальных газов записывают через так называемые приведенные переменные, которые выражают через параметры критического состояния газов:
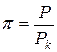 ;
; 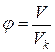 ;
; 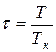
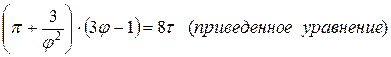
Pk, Vk, Tk – критическое давление, объем, температура газов.
Критические параметры определяются как координаты точек перегиба на изотерме реального газа.
Свойства идеальных и реальных газов отличаются из-за наличия взаимодействия между молекулами реального газа. Мерой отклонения от идеального поведения служит фактор сжимаемости 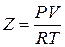 . Для идеальных газов Z=1.
. Для идеальных газов Z=1.
Дата добавления: 2017-09-19; просмотров: 314;
