Термодинамика реальных газовых систем.
К реальным газам законы идеальных газов не применимы вполне строго. Однако, понижая в достаточной степени давление, можно каждый газ при любой данной температуре привести к такому состоянию, что отклонения от свойств идеальных газов будут меньше какой-нибудь заданной конечной величины.
Повышение давления и понижение температуры, увеличивая концентрацию молекул газа и уменьшая расстояния между ними, усиливают отклонения свойств данного газа от свойств идеального газа.
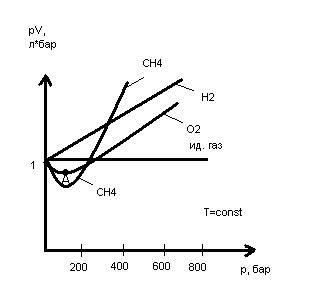
Для идеальных газов при любой постоянной температуре зависимость pV от p должна изображаться прямой, параллельной оси давления. Однако некоторые изотермы имеют минимум (О2), где соблюдается условие pV=const (т.А).
Общий характер этой зависимости объясняется тем, что при сжатии газа, вызывающем сближение его молекул, их взаимное притяжение усиливается, и объем газа уменьшается сильнее, т.е. произведение pV уменьшается (участок 1 до т.А).
(Сжатие, сближение молекул >, fГ-Г > 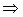 ∆V ↓
∆V ↓ 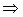 PV < RT для одного моля газа).
PV < RT для одного моля газа).
Но при очень сильном сближении молекул начинает появляться наличие у них собственного объема (который не зависит от давления), и по мере дальнейшего повышения внешнего давления уменьшение объема газа происходит в меньшей степени, чем у идеального газа.
(Р ↑, ∆V ↑, fГ-Г <,PV > RT для одного моля газа).
В области низких давлений все изотермы должны иметь горизонтальный участок, который не всегда виден в большом масштабе. Это следует из закона Бойля-Мариотта (pV=const).
Опытные данные показывают, что в области низких давлений (при 0º C) законы идеальных газов хорошо применимы ко многим реальным газам (N2, H2, O2, CO и т.д.).
Законы идеальных газов лучше всего отражают поведение тех газов, которые наиболее трудно сжижаются, например, водород, гелий, неон. Довольно хорошо эти законы описывают поведение в обычных условиях и при не слишком высоких давлениях таких газов, как азот, кислород, аргон, окись углерода, метан, температура кипения которых близка к температуре кипения жидкого воздуха.
Для всех газов этих двух групп даже при повышении давления до 50 бар, отклонения величины pV от значений, получающихся по уравнению состояния идеального газа, не превышают 5%. Наоборот, для легко конденсируемых газов: двуокиси углерода, двуокиси серы, хлора, хлористого метила и других – указанная величина обнаруживает соответствующие отклонения до 2-3% уже при атмосферном давлении. Таким образом, для них применение закона идеальных газов в тех случаях, когда требуется более высокая точность результатов, не может быть оправдано даже для атмосферных условий.
Дата добавления: 2017-09-19; просмотров: 405;
