ТЕРМОДИНАМИКА РАВНОВЕСИЙ В РЕАЛЬНЫХ ГАЗОВЫХ СИСТЕМАХ. ФУГИТИВНОСТЬ И АКТИВНОСТЬ.
Чтобы проинтегрировать какое-либо термодинамическое выражение функции, например: 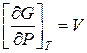 ;
; 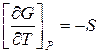 , нужно знать уравнение состояния тела.
, нужно знать уравнение состояния тела.
Для идеальных газов: PV=RT 
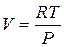 , тогда
, тогда 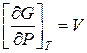 дает
дает 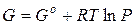 .
.
Для чистого реального газа, состояние которого описывается уравнением Бертло:
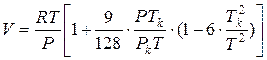
Интегрируем и получаем:
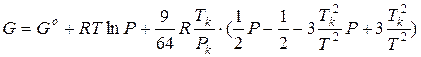
(при интегрировании принято Po = Pстанд = 1 атм).
Расчеты по таким уравнениям трудны и их точность ограничена точностью входящих в них эмпирических констант.
По этой причине вместо давления вводят величину, называемую фугитивностью или летучестью f. Фугитивность имеет размерность давления (Па, атм) и связана с давлением реального газа следующим соотношением:
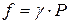
где γ – безразмерный коэффициент фугитивности,зависящий от давления и температуры 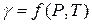 .
.
Фугитивность – это такое давление реального газа, при котором газ ведет себя как идеальный.
При f→P свойства реальных газов приближаются к свойствам идеальных газов, а коэффициент фугитивности стремится к единице γ→1.
В реальной газовой смеси парциальная фугитивность i-го компонента равна:
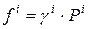
где Рi – парциальное давление i-го компонента в смеси газов.
Применение фугитивности вместо парциальных давлений практикуется при относительно высоких давлениях и низких температурах, когда наблюдаются значительные отклонения от идеальности.
Для 1 моль чистого газа:
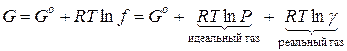 (1)
(1)
Для 1 моль i-го газа в смеси:
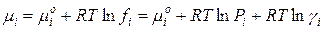 (2)
(2)
где µi0 – стандартный химический потенциал i-го компонента при Р=1 атм, Т=298 К и γ=1.
На основании данных по фугитивности при помощи уравнения (2) можно определить константу равновесия для реального газа.
Для реакции:
аА+вВ=сС+dD
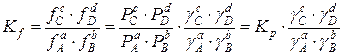
Kf – термодинамическая константа равновесия (безразмерная величина).
Уравнение изобары Вант-Гоффа:
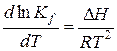
Kf ≠ f (P); Kp=Kf только при малых давлениях, когда реальная газовая смесь приближается к идеальному состоянию.
Тесно связана с фугитивностью и величина активности:
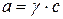
где с – концентрация газа или реального раствора.
Величина активности используется не только применительно к реальным газам, но и к реальным растворам.
γ – безразмерный коэффициент активности, зависит от с и Т, т.е. γ = f (с,Т).
Активность – это такая концентрация, при использовании которой реальные растворы приобретают термодинамические свойства идеальных растворов. Активность имеет размерность концентрации.
Химический потенциал i-го компонента в растворе можно выразить:
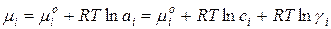
где µi0 – стандартный химический потенциал, когда активность i-го компонента равна единице ai = 1.
Для химических реакций в реальных растворах константу равновесия можно выразить следующим образом:
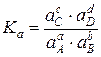 или
или
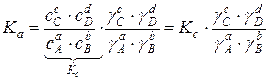 , где
, где
γ – коэффициенты активности для исходных веществ и продуктов реакции.
Таким образом, равновесие химической реакции в зависимости от условий, можно выразить константами равновесия: Kp, Kc, KN, Kf и Ka.
Несмотря на различия констант в различных типах химических реакций, суть у них одна: количественное определение условий равновесия в обратимых процессах.
Дата добавления: 2017-09-19; просмотров: 473;
